短周期元素X、Y、Z、W、Q的原子序数依次增大,各元素原子的最外层电子数之和比Ca2+的核外电子数少1个,X与Q处于同一主族,Y、Z、W处于同一周期的相邻位置。下列叙述不正确的是
| A.X与Z组成的化合物之一可作为火箭发射的高能燃料 |
| B.Y与W形成的阴离子可能有YW32- 或Y2W42- |
| C.化合物Q2W2与X2W反应时,Q2W2只做氧化剂 |
| D.CaX2、CaY2分别与水反应可产生两种可燃性气体 |
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
下列事实不能用勒沙特列原理解释的有( )
①铁在潮湿的空气中容易生锈;
②实验室可用排饱和食盐水的方法收集氯气;
③常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;
④钠与氯化钾共融制备钾Na(l)+KCl(l)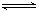 K(g)+NaCl(l);
K(g)+NaCl(l);
⑤二氧化氮与四氧化二氮的平衡体系,加压后颜色加深.
| A.2个 | B.3个 | C.4个 | D.5个 |
FeCl3与KSCN混合时存在下列平衡:Fe3++SCN﹣⇌[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe( SCN)]2+与温度T的关系如图,则下列说法正确的是
| A.FeCl3与KSCN反应的热化学反应方程式为:Fe3++SCN﹣⇌ [Fe( SCN)]2+△H>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1>K2 |
| C.反应处于D点时,一定有V正>V逆 |
| D.T2温度下,向B点溶液中加入FeCl3固体,平衡状态会从 B点变到A点 |
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是 ( )
| A.pH=5.2的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-) |
| B.在滴加酚酞溶液的氨水中,加入NH4Cl溶液恰好无色,则此时溶液的pH﹤7 |
| C.Na2CO3溶液中,c(OH-)-c(H+)= c(HCO3-)+2 c(H2CO3) |
| D.pH=2的一元酸溶液与pH=12的NaOH溶液等体积混合,则溶液的pH一定不大于7 |
常温下,下列离子能使纯水中的OH-离子数目增加的是 ( )
| A.Al3+ | B.CO32- | C.NH4+ | D.Br- |