五种短周期元素的部分性质数据如下:
| 元素 |
T |
X |
Y |
Z |
W |
| 原子半径/nm |
0.037 |
0.075 |
0.099 |
0.102 |
0.143 |
| 最高或最低化合价 |
+1 |
+5,-3 |
+7,-1 |
+6,-2 |
+3 |
下列叙述正确的是
A.X的阴离子半径小于T的阳离子半径
B.Y的氢化物的热稳定性比Z的氢化物的大
C.Y单质与Fe反应生成的化合物中,铁元素显+3价
D.Z元素的氧化物对应的水化物一定为强酸
短周期元素X.Y.Z的原子序数依次递增,其原子的最外层电子数之和为11;Y.
Z在同 一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是()
一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是()
| A.离子半径:Y>X | B.气态氢化物的稳定性:Z>X |
| C.Y的氧化物中含有离子键 | D.Z的氧化物对应的水化物是弱碱 |
下列排列顺序正确的是()
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③沸点:H2Se>H2S>H2O ④结合H+能力:OH->CH3COO->I-
| A.①③ | B.②③ | C.①④ | D.②④ |
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是()
| A.原子半径 A>B>D>C | B.原子序数 b> a >d>c |
| C.离子半径 C>D>B>A | D.单质的还原性 A>B>D>C |
用密度为ρ1 g/cm3,质量分数是ω的浓盐酸,配制成体积比为1∶4的稀盐酸,密度为ρ2g/cm3,则所配制稀盐酸的物质的量浓度为()
A.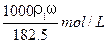 |
B. |
C. |
D. |
下列关于热化学反应的描述中正确的是()
| A.HCI和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH) 2反应的中和热△H=2×(-57.3)KJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的 △H=2×283.0kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |