室温时,0.01mol·L-1HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,下列有关叙述正确的是
| A.原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B.当恰好完全中和时,溶液呈中性 |
| C.当滴入少量的NaOH,促进了HA的电离,溶液的pH升高 |
| D.当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
下列关于金属钠的叙述中,正确的是
| A.为防止钠与水反应时燃烧,可将该反应置于试管中进行,以减少与氧气的接触 |
| B.钠着火时应用干燥的沙土灭火 |
| C.钠在空气中受热时,熔化为银白色的小球,产生黄色的火焰,生成白色粉末 |
| D.钠在空气中长期放置,最终主要生成物为过氧化钠 |
下列实验操作中,正确的是
| A.在蒸发食盐水时,边加热边用玻璃棒搅拌直至液体蒸干 |
| B.焰色反应实验前,铂丝应先用盐酸洗净,在酒精灯外焰灼烧至没有颜色 |
| C.实验室制备氢氧化铁胶体时,向饱和三氯化铁溶液中滴加氢氧化钠溶液 |
D.配制一定物质的量浓度的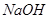 溶液,将 溶液,将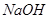 固体放在容量瓶中加水溶解 固体放在容量瓶中加水溶解 |
下列关于胶体的叙述中,不正确的是
| A.胶体是一种介稳体系 |
| B.胶体和悬浊液都能透过滤纸 |
| C.利用丁达尔效应可以区分溶液和胶体 |
| D.胶体中分散质粒子的直径小于1nm |
下列试剂中,能用带玻璃塞的试剂瓶贮存的是
| A.氢氟酸 | B.氢氧化钠溶液 | C.盐酸 | D.水玻璃 |
下列有关硅元素的叙述中,正确的是
A. 不溶于水,也不溶于任何酸 不溶于水,也不溶于任何酸 |
B. 是良好的半导体材料 是良好的半导体材料 |
| C.硅是地壳中含量最多的元素 | D.水玻璃可用作木材防火剂 |