下列有关实验操作、现象和解释或结论都正确的是
| 选项 |
实验操作 |
现象 |
解释或结论 |
| A |
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 |
溶液呈红色 |
稀HNO3将Fe氧化为Fe3+ |
| B |
Agl沉淀中滴入稀KCl溶液 |
有白色沉淀出现 |
AgCl比Agl更难溶 |
| C |
Al箔插入稀HNO3中 |
无现象 |
Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
下列有关生物学实验的叙述,正确的是
| A.叶绿体色素滤液细线浸入层析液,可导致滤纸条上色素带重叠 |
| B.鉴定脂肪的存在,可用显微镜观察是否有被染成橘黄色或红色的颗粒 |
| C.用显微镜观察洋葱根尖装片时,需保持细胞活性以便观察有丝分裂过程 |
| D.将洋葱表皮放入0.3g/mL蔗糖溶液中,水分交换平衡后制成装片观察质壁分离过程 |
水污染、水资源短缺导致的水危机日趋严重,研究表明,80%的疾病是由水污染引起的。下列有关人体内水的叙述,不正确的是
| A.水在病变细胞中以结合水和自由水形式存在 |
| B.在肌糖原的合成过程中伴随着水的产生 |
| C.人体衰老细胞中自由水含量减少,代谢缓慢 |
| D.冬季,植物体内自由水含量相对增高,以增强植物的抗寒能力 |
下列关于细胞核的叙述正确的是
| A.真核细胞的核膜上有大量的多种酶,有利于多种化学反应的顺利进行 |
| B.在光学显微镜下观察真核细胞,可以看到细胞核的主要结构有核膜、核孔、核仁和染色体 |
| C.真核细胞的核膜上有核孔,脱氧核糖核酸等大分子物质可以通过核孔进入细胞质 |
| D.原核细胞的拟核除没有核膜外,其他方面与真核细胞的细胞核没有差别 |
下列叙述中能对蛋白质的功能进行高度概括的是
| A.细胞和生物体的重要结构物质 |
| B.收缩、运输、免疫等生理活动的物质基础 |
| C.生命活动的主要承担者 |
| D.调节细胞和生物体新陈代谢的重要物质 |
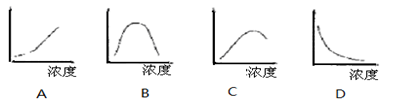
将5块去皮的、并切成形状、体积相同的马铃薯条,分别放在不同浓度的蔗糖溶液中,放置一段相同的时间后,测定五条马铃薯条的长度并作图。下图能代表实验结果的是(纵坐标表示马铃薯条的长度)