将CO2转化为甲醇的原理为 CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是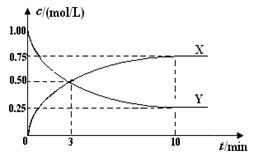
| A.曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化 |
| B.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min) |
| C.平衡时H2的转化率为75% |
| D.500 ℃时该反应的平衡常数K=3 |
全球气温上升导致两极冰川融化,海平面上升 。为了减缓全球日益加重的温室效应,科学家们利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO;并在一定条件下将H2、CO合成有机物,其过程如下:
mCeO2 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法正确的是( )
| A.该过程中CeO2参与反应且有消耗 |
| B.该过程实现了化学能向太阳能的转化 |
| C.上图中ΔH1=ΔH2+ΔH3 |
| D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-===CO+2H2O |
短周期元素X、Y、Z、W、Q在元素周期表中的位置如下表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
| X |
Y |
||
| Z |
W |
Q |
A.W得电子能力比Q强
B.由Z与Y组成的物质在熔融时能导电
C.钠与Y可能形成Na2Y 2化合物且该化合物离子键和共价键
D.X有多种同素异形体,而Y不存在同素异形体
下列实验现象及相关结论错误的是( )
| A |
B |
C |
D |
|
| 实验 |
 |
 |
 |
 |
| 现象 |
品红褪色 |
最后试管有浅黄色沉淀 |
溶液刚出现粉红色 |
金属Ⅰ上有红色的铜析出 |
| 结论 |
SO2有漂白性 |
有机物中含有溴原子 |
滴定达到终点 |
金属Ⅱ比Ⅰ活泼 |
用碱性氢氧燃料电池为电源进行电解的实验装置图如图所示,下列说法中正确的是( )
A.燃料电池工作时,正极反应为:O2+2H2O+4e- 4OH- 4OH- |
| B.a极是碳,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.CuSO4溶液电解结束后溶液呈中性 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
对于反应CO2(g)+H2(g)  CO(g)+H2O(g) ΔH>0,在其他条件不变的情况下( )
CO(g)+H2O(g) ΔH>0,在其他条件不变的情况下( )
| A.加入催化剂,改变了反应的速率,反应的ΔH也随之改变 |
| B.降低温度,反应速率加快,反应放出的热量不变 |
| C.改变反应体系体积,平衡不发生移动,反应放出的热量不变 |
| D.若将上述反应改为在燃料电池进行,反应放出的热量不变 |