对MgCl2、Al2O3、Fe2O3和SiO2组成的混合物进行下列处理,以制取金属Z,并提纯氧化铝。
(1)①和②步骤中分离溶液和沉淀的操作是:
(2)金属Z名称为 ;残渣A为 ,固体C是
(3)滤液B的溶质有(填化学式)
(4)写出电解Y 的化学方程式
(5)写出X→B的离子方程式
(6)实验室里常往AlCl3溶液中加入 (填“氨水”或“NaOH溶液”)来制取Al(OH)3固体,其反应的离子方程式为
A、B、C、W、X、Y、Z是由周期表中短周期元素组成的七种物质,其中A、B、C是三种固体单质,W、X、Y、Z是由两种元素组成的化合物。它们之间的转化关系如图所示(所有反应物和生成物均未在框图中: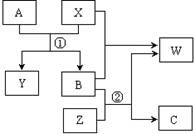
回答下列问题:
(1)化合物Z的晶体类型属于__________晶体。
(2)写出单质C的一种用途__________________________________。
(3)航天科技测知化合物N是金星大气层的成分之一,组成化合物N的元素与W相同。已知N中两种元素的质量之比为2:1,N的相对原子质量小于80,则N的化学式为_____________。又知该分子中的每个原子都满足最外层8电子的稳定结构,试写出其电子式_________________。
(4)写出下列反应的化学方程式:
①__________________________________;
②__________________________________。
在100℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,发生反应:
2NO2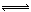 N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间/s |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
(1)在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为__________
mol/(L·s)。
(2)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是_________mol/L。假设在80s时达到平衡,请在如图中画出该条
件下N2O4和NO2的浓度随时间变化的曲线。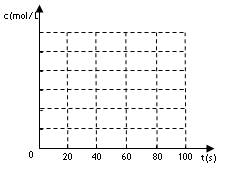
(3)上述(2)达到平衡后四氧化二氮的转化率为_________,混合气体的平均摩尔质量
为___________。
(4)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡将(填“向左移动”、“向右移动”或“不移动”)。
(有机化学基础)A为含有C、H、O三种元素的芳香烃的衍生物,各物质间的转化关系如图所示。已知:ROH+HX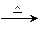 RX+H2O;E为高分子化合物,分子式为((C9H8O2)n;H分子式为C18H15O6Na;I中含有一个苯环,还含有一个六元杂环。
RX+H2O;E为高分子化合物,分子式为((C9H8O2)n;H分子式为C18H15O6Na;I中含有一个苯环,还含有一个六元杂环。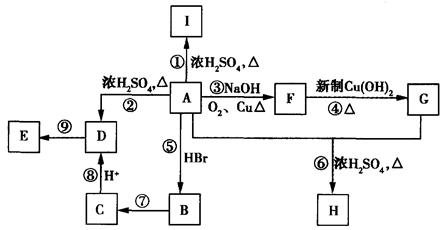
回答下列问题:
(1)I的结构简式________。
(2)写出有关反应的反应类型:反应②为_______,反应⑤为_________,
(3)写出反应⑦的化学方程式_____________________________。
(4)A的同分异构体有多种,写出符合下列条件的A的两种同分异构体的结构简式。
①A分子中有两个对位取代基;
②与FeCl3溶液能发生显色反应;
③能发生银镜反应_____________________________
(物质结构与性质)有A、B、C、D、E、F 6种元素,B原子得到一个电子后3p轨道全充满,A+比B形成的简单离子少一个电子层;C原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价和最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数为26。请回答下列问题:
(1)A元素位于元素周期表中第_________周期第__________族;;F元素基态原子形成的+3价阳离子的电子排布式为___________。
(2)C与B形成的CB3分子中C原子的杂化方式是____________,其分子的空间构型是____________
(3)另一元素X与A同主族,第一电离能小于A,晶体XB与AB中熔点较高的是 _____________,其理由是______________________
(4)1mol ED晶体中含有的E—D键的数目是____________。
熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
请回答下列问题:
(1)B极为_________极,发生_________(填“氧化”或“还原”)反应。
(2)电池总反应为___________________________________________。
(3)以此电源电解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为g。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是(用化学方程式表示)