常温下,下列说法不正确的是
| A.0.1 mol/L的Na2SO3溶液中粒子浓度关系:c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+) |
| B.将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液pH都减小 |
| C.把等体积的1×10-5 mol/L的硫酸与4×10-5 mol/L的NaOH溶液相混合,混合液的pH值与5×10-6 mol/L的Ba(OH)2溶液的pH值相同 |
| D.0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )
| A.由水电离产生的c(H+)=10-12 mol/L的溶液中:K+、Na+、ClO-、I- |
B.c(H+)=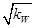 mol/L的溶液中:K+、Fe3+、Cl-、CO32— mol/L的溶液中:K+、Fe3+、Cl-、CO32— |
C.常温下,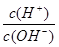 =1×10-12的溶液:K+、AlO2—、CO32—、Na+ =1×10-12的溶液:K+、AlO2—、CO32—、Na+ |
| D.pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42— |
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大
②溶液的pH<7
③溶液中c(Na+)=c(A2-)
④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
| A.①②③④ | B.①③④ | C.①③ | D.②④ |
水中加入下列溶液对水的电离平衡不产生影响的是( )
| A.NaHSO4溶液 | B.KF溶液 | C.KAl(SO4)2溶液 | D.NaI溶液 |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图8-2(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )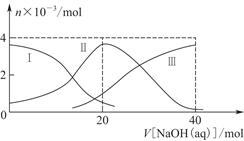
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A=HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
c(HA)/mol·L-1 |
c(NaOH)/mol·L-1 |
混合后溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
b |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH<7 |
| 丁 |
0.1 |
0.1 |
pH=c |
下列对混合后溶液的有关说法中,不正确的是( )
A.甲中:若a=7,则HA是强酸
B.乙中:若b≠0.2,则c(A-)≠c(Na+)
C.丙中:若HA是弱酸,则c(A-)>c(Na+)>c(H+)>c(OH-)
D.丁中:若c=9,则c(OH-)-c(HA)=10-9 mol·L-1