氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程: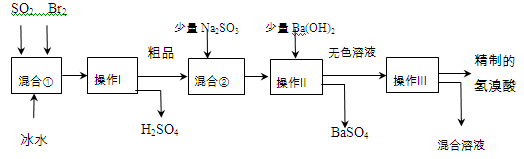
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)操作Ⅱ的名称是 。
(3)操作Ⅲ一般适用于分离 混合物。(选填编号)
| A.固体和液体 | B.固体和固体 |
| C.互不相溶的液体 | D.互溶的液体 |
(4)混合②中加入少量Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为含_______,其用于证明该假设所用的试剂为 。
铁及其化合物在生产和生活中有着广泛的应用。某实验小组设计了如下实验探究
某些含铁化合物的制备、组成、性质等。请按要求回答下列问题:
(1)铁的氯化物的制备与组成:在实验室中,FeCl2可用________和盐酸反应制备,FeCl3可用铁粉和
________反应制备。现有一含有FeCl2和FeCl3的混合物样品,测得n(Fe)∶n(Cl)=1∶2.2,则该样
品中FeCl2和FeC13物质的量之比为__________。
(2)水处理剂和高容量电池材料――高铁酸钾(K2FeO4)的制备与应用:
FeC13与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
________________________________________________________________________;
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,其正极电极反应式为
________________________________________________________________________。
(3)光敏材料三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)中铁元素含量的测定:
步骤一:称量10.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳。同时MnO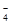 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0200 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO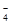 还原成Mn2+。
还原成Mn2+。
重复步骤二、三操作,步骤三消耗0.0200 mol/L KMnO4溶液19.98 mL。
①步骤一中除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有____________________;步骤三滴定过程中盛装KMn4溶液的仪器名称为___________;滴入最后一滴溶液时,锥形瓶中溶液变为_________色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②步骤二加入锌粉的目的是_______________________________;
写出锌参与反应的离子方程式:____________________________________________。
③实验测得该晶体中铁元素的质量分数为____________。在步骤二中,若加入的KMnO4溶液的量不足,则测得的铁元素含量____________。(填“偏低”“偏高”或“无影响”)
四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃。装置A中放浓盐硫,B中放MnO2,二者用于制氯气,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。请回答下列各问题。
(1).上图中气体发生和尾气处理装置不够完善,请你提出改进意见_______________________________。
利用改进后的正确装置进行实验,请回答下列问题:
(2)H中反应的离子方程式:_________________________________________________;
E中反应的化学方程式:________________________________________________。
(3)C、D中的试剂分别是_______________、____________________。
(4)仪器A、B的名称分别是_____________、____________,F的作用是_____________。
(5)实验时应先点燃_________处酒精灯,加热温度应大于________ ℃,待________,即可停止加热。
(6)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为________________________________________________________________。
(7)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是___________________________。
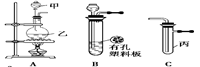
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
|

| 实验序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将氯水滴入品红溶液 |
溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
氯水中加入 NaHCO3粉末 |
有无色气泡产生 |
氯气与水反应的产物具有较强的酸性 |
(2)请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。
。
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
。
B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
(4)B中发生反应的化学方程式为 。
(5)欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是
。
(6)试管丁中的NO2与一定量的O2混合后倒插水中,试管9/10充满水,则原试管丁中的混合气体的平均分子量可能为 。(保留二位小数)
下面是一些实验室制备硫酸铜的实验设计。
实验一:用铜与浓硫酸反应制取硫酸铜。
实验二:将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全制取硫酸铜。(装置如下图中的图I.图Ⅱ)。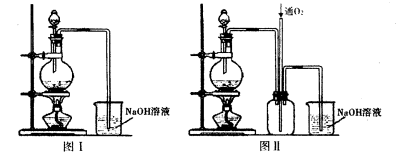
实验三:将铜粉在某仪器中反复灼烧,使铜粉充分与空气发生反应生成氧化铜,再将氧化铜与稀硫酸反应,经后续步骤可得到硫酸铜晶体。
实验四:向铜粉和稀硫酸的混合物中加入H2O得到硫酸铜。
请回答实验中的有关问题。
(1)实验一中发生反应的化学反应方程式为____,这种方法的缺点是____。
(2)实验二装置图中分液漏斗里盛装的液体是____。图Ⅱ是图I的改进装置,分析图II装置的优点是。
(3)实验三中用于灼烧的仪器名称是。该实验中的后续步骤指的是__。
(4)实验四中发生反应的化学方程式为____。
(5)除上面的实验设计外,请你再设计一种只用铜和稀硫酸为原料制取硫酸铜的方法(写出化学反应方程式)。
氧化铜是一种黑色粉末,其制品除在烟花中使用外还可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂。为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源回收再利用,减少污染。
(1)获得硫酸铜
该小组同学利用H2O2和H2SO4混合溶液可溶出印刷电路板金属粉末中的铜,从而获得硫酸铜。
写出该反应的化学方程式。
(2)制备氧化铜
①步骤I的目的是除去可溶性杂质;
②步骤II的目的是得到CuSO4·5H2O固体。该步骤操作是、、过滤、水浴加热烘干。水浴加热的特点是。
(3)探究氧化铜是否能加快氯酸钾的分解并与二氧化锰的催化效果进行比较。用如图装置进行实验,实验时均以收集25mL气体为准,其他可能影响实验的因素均已忽略,相关数据见下表:
回答下列问题:
①上述实验中的“待测数据”指。
②若要证明实验II中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,。
③为探究CuO在实验III中是否起催化作用,需补做如下实验(无需写出具体操作):
a.CuO的化学性质有没有改变;b。.