下列关于金属的说法中,不正确的是
| A.常温下可用铁制容器盛装浓硝酸 |
| B.在一般情况下,合金的硬度大于它的成分金属 |
| C.常用电解法冶炼钠、镁、铝等活泼金属 |
| D.将钢闸门与电源正极相连,可防止其在海水中被腐蚀 |
相同温度下,等物质的量浓度的下列溶液中,pH值最小的是
A.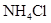 |
B.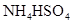 |
C.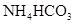 |
D.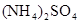 |
下列化学用语与鲍林有关的是
| A.原子学说 | B.构造原理 |
| C.电负性 | D.半充满、全充满 |
下列化工生产原理错误的是
①可以用电解熔融的氯化钠的方法来制取金属钠 ②可以用钠加入氯化镁饱和溶液中制取镁 ③电解法炼铝时,原料是氯化铝 ④炼铁高炉中所发生的反应都是放热的,故无需加热
| A.②③ | B.①③ | C.①②③ | D.②③④ |
关于电解NaCl水溶液,下列叙述正确的是
| A.电解时在阳极得到氯气,在阴极得到金属钠 |
| B.若在阳极附近的溶液中滴入KI淀粉溶液,溶液呈蓝色 |
| C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色 |
| D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 |
已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可作钡餐,BaCO3不能作钡餐的主要理由是
| A.BaSO4的溶度积常数比BaCO3的小 |
| B.S没有毒性,C有毒性 |
| C.BaSO4的密度大 |
| D.胃酸能与CO32-结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒 |