(选考)[化学——选修物质结构与性质](15分)
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。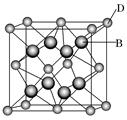
请回答下列问题:
(1)E元素原子基态时的电子排布式为________。
(2)A2F分子中F原子的杂化类型是________,F的氧化物FO3分子空间构型为________。
(3)CA3极易溶于水,其原因主要是______________________,试判断CA3溶于水后,形成CA3·H2O的合理结构:________(填字母代号),推理依据是____________________________。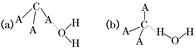
(4)从图中可以看出,D跟B形成的离子化合物的化学式为_________________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________________________(写出表达式即可)。
硫酸最古老的生产方法是:把绿矾装入反应容器中加强热,会流出油状物,并放出有刺激性气味的气体,反应容器中的固体变为红色。这个变化过程可用两个化学方程式表示:,。
接触法制硫酸的原料是,生产过程的化学反应原理是:。
以下可逆反应中,达到平衡后,通过升高温度可提高反应物转化率的是;通过增大压强可提高反应物转化率的是;改变压强,转化率不变的是。
①A(s)+B(g)  C(g),ΔH < 0;
C(g),ΔH < 0;
②N2(g)+3H2(g)  2NH3(g), ΔH < 0;
2NH3(g), ΔH < 0;
③2NO2(g)  2NO(g) +O2(g),ΔH > 0;
2NO(g) +O2(g),ΔH > 0;
④2SO2(g)+O2(g)  2SO3(g) ,ΔH < 0。
2SO3(g) ,ΔH < 0。
⑤CO(g)+NO2(g)  CO2(g) +NO(g),ΔH < 0;
CO2(g) +NO(g),ΔH < 0;
冶金工业上为降低硫的氧化物对空气的污染,常用CO在500℃、铝矾土催化下还原SO2,处理烟道废弃回收硫,写出该反应的化学方程式。
硫酸工业常用收SO3,是为了避免;在生产过程中为了提高原料的利用率,常用、。