(18分)一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159g/cm3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280mL/mL水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制造一氯甲烷: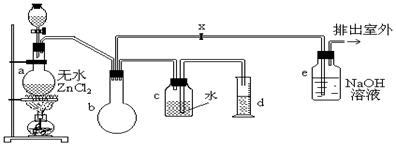
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式 ,其反应类型属于 反应;
(2)装置b的作用是 ;
(3)已知卤代烃能发生碱性水解,转化为醇。装置e中可能发生的反应方程式为 ;
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。CH3Cl燃烧的化学方程式是 ;
(5)实验中实际按甲醇和浓盐酸1︰2(物质量之比)进行反应的理由是 ;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~
浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是 ;
(7)实验结束后,d中收集到的液体中含有 。
某实验小组利用反应2CuO+2Cl2 2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。
2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。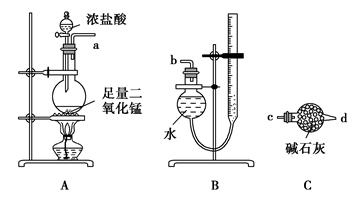
方案一:通过测定反应物CuO的质量m(CuO)和产物O2的体积V(O2)来测定铜的近似相对原子质量。
(1)按气流方向从左到右用胶管(图中未画出)将选择的仪器组合成一套实验装置,连接顺序为a→( )( )→( )( )→( )( )→( )( )→b。
(2)装置B是由干燥管和碱式滴定管改造而成的测量气体体积的装置,实验前滴定管液面初读数为V1 L,实验后恢复到室温,调节装置两侧液面相平后得到末读数为V2 L,设室温时气体摩尔体积为Vm L·mol-1,且E装置中CuO的质量为m1 g,充分反应后生成CuCl2的质量为m2 g,则铜的近似相对原子质量的表达式为
[用含m1、V1、V2的代数式表示]。
(3)若氧化铜中混有铜,则测定结果(填“偏大”、“偏小”或“无影响”)。
(4)装置E在实验过程中的主要现象是。
方案二:利用A、D、E、F四套装置(尾气由其他的装置处理)完成测定任务。
(5)你认为测定的物理量有(写出一组),按你测定的物理量,写出铜的近似相对原子质量的表达式:。
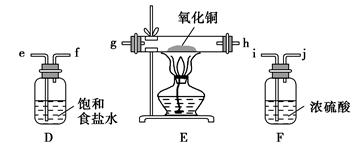
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得
高纯硅。以下是实验室制备四氯化硅的装置示意图。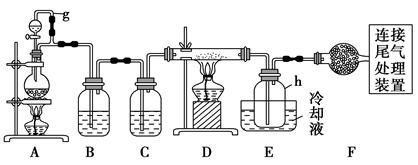
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
| 熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
| 升华温度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:。
(2)装置A中g管的作用是;装置C中的试剂是;装置E中的h瓶需要冷却的理由是。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是(填写元素符号)。
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅,同时得到一种可燃性气体;
②粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl SiHCl3+H2);
SiHCl3+H2);
③SiHCl3与过量的H2在1 100~1 200 ℃的温度下反应制得纯硅,已知SiHCl3能与水剧烈反应,在空气中易自燃。
请回答:
(1)第一步制取粗硅的化学反应方程式为。
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为。
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):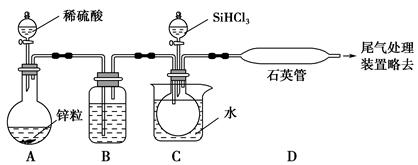
①装置B中的试剂是,装置C中的烧杯需要加热,目的是。
②反应一段时间后,装置D中观察到的现象是,装置D不能采用普通玻璃管的原因是,装置D中发生反应的化学方程式是。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及。
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)提出猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有(填化学式,下同)。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:
a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
| 选用试剂 |
实验现象 |
|
| 方案1 |
||
| 方案2 |
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为。
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
写出其中SO2表现还原性的离子反应方程式:。
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是。
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是。
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体mol(不考虑溶解的SO2)。