PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)在一个密闭容器中,发生反应:C(s)+H2O(g)  CO(g)+H2(g)则该反应正向反应是: 反应(填:放热、吸热),该反应化学平衡常数表达式为K= ,达到平衡后,若减小密闭容器的容积,保持温度不变,原化学平衡向 反应方向移动,v(正) (填:不变、变大、变小)。
CO(g)+H2(g)则该反应正向反应是: 反应(填:放热、吸热),该反应化学平衡常数表达式为K= ,达到平衡后,若减小密闭容器的容积,保持温度不变,原化学平衡向 反应方向移动,v(正) (填:不变、变大、变小)。
(2)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇(CH3OH)。
①已知在常温常压下:2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从 (填“c”或“b”)口通入,电池负极反应式为_______________________________。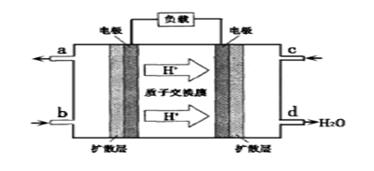
(3)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g) ΔH<0 若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是______________。
(4)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,0.5分钟后达到平衡,测得容器中含SO3 0.18mol,则v(O2)=________mol/(L•min),若继续通入0.20mo1SO2和0.lmolO2,则达平衡时SO2的转化率_______(填“不变”、“增大”“减小”)
(5)25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
某密闭容器中,有A、B两种气体,反应按下式进行A(g)+B(g)=2C(g)反应经过2s后浓度不再发生变化时,测得容器中各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75 mol/L,c(C)=0.5 mol/L。
(1)B物质的起始浓度各为
(2)2s时A的转化率
(3)用物质A表示反应的平均速率
已知下热化学方程式:
①H2(g)+1/2O2(g)= H2O(l) ⊿H= —285.8 kJ/mol
②H2(g)+1/2O2(g)= H2O(g) ⊿H= —241.8kJ/mol
③C(s)+1/2O2(g) =" CO" (g) ⊿H= —110.5kJ/mol
④C(s)+ O2(g) = CO2(g) ⊿H= —393.5kJ/mol
回答下列问题:
(1)上述反应中属于放热的是
(2)H2的燃烧热为 ,C的燃烧热为
(3)燃烧10g H2生成液态水,放出的热量为
(4)CO的燃烧热为 ,其热化学方程式为
在一定条件下,xA+yB zC的反应达到平衡。
zC的反应达到平衡。
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则向 移动。(填“正”、“逆”、“无法判断”)
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是 态。(填“气”、“液”、“固”)
(4)加热后C的质量分数减少,则正反应是 热反应。
为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)该反应的平衡常数表达式K= ;
(2)从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)= (注明单位);H2的转化率= ;
(3)下列说法中,能说明上述反应达到平衡状态的是
A.每消耗1mol CO2的同时生成1mol CH3OH
B.CO2、H2、CH3OH和H2O的物质的量的比为1:3:1:1
C.容器中气体的压强不再改变
D.容器中气体的密度不再改变
(4)下列措施中,能使上述平衡状态向正反应方向移动的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用高效催化剂
D.恒温恒容再充入1 molCO2和3 mol H2
现有下列十种物质:①Na2O ②Cu(OH)2 ③Zn ④CaCO3 ⑤硫酸溶液 ⑥Ba(OH)2 ⑦干冰 ⑧A12(SO4)3 ⑨HCl水溶液 ⑩KHSO4
(1)其中属于非电解质的有 (填序号)。
(2)写出下列物质在水溶液中相互反应的离子方程式:
⑤ + ⑥
④ + ⑨
(3)往②中加入过量的0.1 mol/L⑩的水溶液,发生反应的离子方程式是 ,向所得溶液中继续加入③,会产生无色气泡,该反应的离子方程式是 。