某学生为了测定由两种元素形成的气态化合物X的组成,进行了如图所示的实验,将装置内空气排尽后,把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应(气态化合物X与CuO均无剩余),得到如下结果: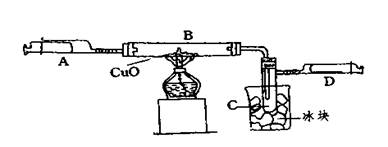
①实验前B管及药品的质量为21.32克,实验后为21.16克
②C管中收集到的物质电解后可得到H2和O2,在D中收集到的是N2。
③X中两元素的质量比是14:3。问:
(1)C中收集到的液体,物质的量是 mol;
(2)在实验中看到的现象是 。
(3)B中反应的化学方程式是 。
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
| 元素 |
有关信息 |
| X |
最外层电子数是次外层的2倍 |
| Y |
元素的主要化合价为-2价 |
| Z |
其单质及化合物的焰色为黄色 |
| M |
与X同主族,其单质为半导体材料 |
| N |
其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
(1)XY2的电子式是;Z2Y2中所含化学键类型是;XY2与Z2Y2反应的化学方程式是。
(2)恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g) 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1K2。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1K2。
(3)X的非金属性比M(填“强”或“弱”),能证明此结论的事实是(用离子方程式表示)。
某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下:
|
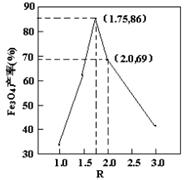
 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
溴及其化合物广泛应用在有机合成、化学分析等领域。
(1)海水提溴过程中溴元素的变化如下: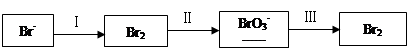
①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。
ⅰ.通入氯气后,反应的离子方程式是______。
ⅱ.调海水pH可提高Cl2的利用率,用平衡原理解释其原因是______。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
Br2+ Na2CO3=
Na2CO3= NaBrO3+
NaBrO3+ CO2+
CO2+ ______
______
③过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。
相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是______。
(2)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
| 粒子 |
I2 |
Br2 |
IO3- |
| 物质的量/mol |
0.5 |
1.3 |
则原溶液中NaI的物质的量为______mol。
活性炭可处理大气污染物NO。T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
| 活性炭/mol |
NO/mol |
A/mol |
B/mol |
|
| 起始状态 |
2.030 |
0.100 |
0 |
0 |
| 2 min时 |
2.000 |
0.040 |
0.030 |
0.030 |
(1)2 min内,用NO表示该反应的平均速率v(NO)=______mol·L-1·min-1。
(2)该反应的化学方程式是______;T℃时,它的平衡常数K=9/16,则2 min时反应______(填“是”或“不是”)平衡状态;已知升高温度时,K增大,则该反应为______(填“吸热”或“放热”)反应。
(3)为了提高反应速率和NO的转化率,可采取的措施是______。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
| Q |
R |
||
| T |
W |
(1)T的原子结构示意图是______。用化学方程式表示工业常用冶炼T单质的原理是______。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中存在的共 价键的类型是______。
(3)元素的非金属性:Q______W(填“强于”或“弱于”),结合方程式简述其原因是______。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应水化物,实验步骤:将盛有甲的试管倒扣在水槽中,______。