下列说法不正确的是
| A.0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32- ) |
| B.将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水量多 |
| C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) |
| D.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
关于下列装置说法正确的是()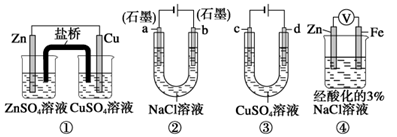
| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.装置②工作一段时间后,a极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
如图所示,杠杆A、B两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,小心地向水槽中滴入CuSO4浓溶液。(该过程中不考虑两球浮力的变化)下列说法正确的是()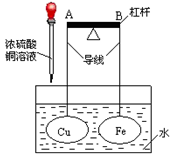
A.若杠杆由绝缘体材料制成,一段时间后,杠杆一定B端高A端低
B.若杠杆由导体材料制成,一段时间后,杠杆一定B端高A端低
C.若杠杆由导体材料制成,一段时间后,杠杆一定A端高B端低
D.无论杠杆由绝缘体材料还是由导体材料制成,一段时间后,杠杆一定A端高B端低
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如右图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(KJ)是( )
| A.194 | B.516 | C.391 | D.658 |
下列叙述正确的是()
| A.铁与稀H2SO4反应时,加入少量CuSO4溶液,可使反应速率加快 |
| B.构成原电池的正极和负极必须是两种不同的金属 |
| C.在铁片上镀铜时,金属铜作阴极 |
| D.用惰性电极电解CuSO4溶液,溶液的pH不变 |
用惰性电极电解下列溶液,一段时间后,加入一定质量的另一种物质(括号中),溶液能与原溶液完全相同的是()
| A.CuCl2(CuSO4) | B.NaOH(H2O) | C.AgNO3 (AgNO3) | D.CuSO4(Cu2O) |