(15分:除注明分数的小题之外,其余为1分))
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空: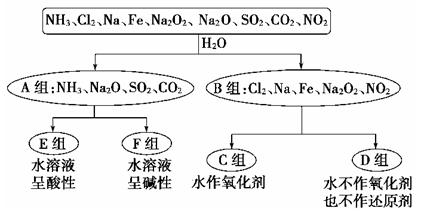
(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_________。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:___ 。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。
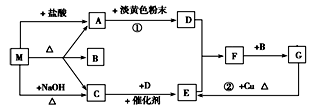
(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式_________________________________________。
(3)反应②的离子方程式_________________________________________。
(4)F→G的化学方程式___________________________________________。
某同学用某种粗盐进行提纯实验,步骤见下图。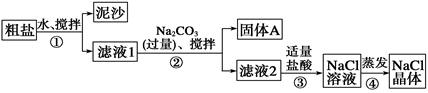
请回答:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是______________;
步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止____________,当蒸发皿中有较多量固体出现时,应______________,用余热使水分蒸干。
(3)猜想和验证:
| 猜想 |
验证的方法 |
现象 |
结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 |
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
① |
猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 |
取少量固体A于试管中,先滴入②,再滴入Na2SO4溶液 |
有气泡放出,无白色沉淀 |
③ |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体溶于试管中的蒸馏水, ④ |
⑤ |
猜想Ⅲ成立 |
科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。
(1)下列各组物质中有一种物质从化学性质角度看与其它物质不属于同一类,请将其挑出来(余下的必须属于同类),并说明理由。
| 物质组 |
不属于同类的物质 |
理由 |
| (1)MgO、SO3、CaO、Al2O3 |
||
| (2)H2O、HBr、CH4、NH3 |
||
| (3)HCl、H2SO4、HNO3、H3PO4 |
(2)请对以下过程形成的分散系进行分类
①花生油加入到水中后充分搅拌;
②向蒸馏水中加入硝酸钾至恰好饱和;
③饱和氯化铁溶液中逐滴加入少量氢氧化钠溶液;
④氢氧化钡溶液中通入过量的CO2;
⑤用滤纸过滤氢氧化铁胶体后得到的滤液;
⑥将纳米材料分散在塑料中制备复合材料;
⑦碘水和酒精的混合物。
属于浊液的是:____(填序号,下同);属于溶液的是:_____;属于胶体的是:_____。
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H2=-511KJ/mol
下列说法正确的是()
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |
(1)CO、CH4均为常见的可燃性气体。已知在101kPa时,CO的燃烧热为283kJ/mol。相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是。
(2)已知:P4(g)+6Cl2(g)=4PCl3(g)△H=a kJ∙mol—1
P4(g)+10Cl2(g)=4PCl5(g)△H=b kJ∙mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为1.2c kJ∙mol—1。则Cl-Cl键的键能为kJ∙mol—1
(3)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H
为(用△H1、△H2、△H3表示)
(4)已知一定温度和压强下,合成氨反应:
N2(g)+3H2(g) 2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是(填“吸收”或“放出”) kJ热量。
2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是(填“吸收”或“放出”) kJ热量。
已知A(g)+B(s) C(g)+D(g)△H<0,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B。回答下列问题:
C(g)+D(g)△H<0,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B。回答下列问题:
(1)如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1,则6s时c(A)=mol·L-1, C的物质的量为mol;若反应经一段时间后,达到平衡,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率(填“变大”、“变小”或“不变”);
(2)判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(3)100℃时,该反应达到平衡后,D的浓度为0.02mol/L,改变反应温度为T,c(A)以0.001mol/(L·s)的平均速率降低,经10s又达到平衡。
①T100℃(填“大于”或“小于”),判断理由是;
②温度T时,反应达到平衡后,将反应容器的体积减少一半。平衡向(填“正反应”或“逆反应”)方向移动。