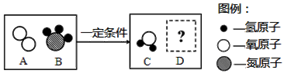下图所示为实验室中常见的气体制备和收集装置。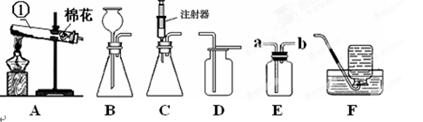
请回答下列问题:
(1)图中标有①的仪器名称是 。
(2)实验室用高锰酸钾制取氧气,应选用发生装置 (填字母序号),反应的化学方程式为 ;实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,你认为选用C的优点是 。
(3)实验室用B装置制取二氧化碳,反应的化学方程式 ,欲使用E装置收集二氧化碳,则气体应从 (填“a”或“b”)端通入。
(4)除去一氧化碳中的二氧化碳(氢氧化钠溶液只和二氧化碳反应),并将一氧化碳收集在集气瓶中,下列装置中最为合理的是 。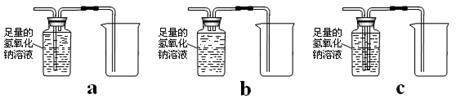
(3分)化学就在我们身边,它与我们的生活息息相关。现有
| A.金刚石; |
| B.烧碱; |
| C.盐酸; |
| D.二氧化硫; |
E.葡萄糖;
F.碳酸钾,
请用相应物质的化学式填空。
(1)人体胃液中含有的酸是;
(2)易吸水而潮解的碱是;
(3)草木灰的主要成分是;
(4)自然界中最坚硬的物质是;
(5)医学上称为“低血糖”的糖是:
(6)能使高锰酸钾溶液褪色并引起酸雨的是。
镁及其化合物在生产、生活中应用广泛。
(1)从海水中提取金属镁,可按下图流程进行:
①下列说法正确的是(填字母)。
A.步骤Ⅰ通过一步反应即可实现
B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁
C.步骤Ⅴ中化学能转化为电能
D.该流程涉及的基本反应类型有4种
②该流程中采取的一种降低成本且减少污染的措施是。
(2)某化学兴趣小组对某种碱式碳酸镁晶体的组成进行探究。
【查阅资料】①碱式碳酸镁晶体可以表示为xMgCO3•yMg(OH)2•zH2O;②Mg(OH)2、MgCO3受热均能分解生成对应的氧化物;③碱石灰是固体氢氧化钠和生石灰等物质的混合物。
【设计实验】该小组同学设计了下图所示的实验装置,假设每步反应和吸收均进行完全。
【进行实验】取23.3g碱式碳酸镁晶体进行实验,步骤如下:
①连接好装置并检查气密性。
②装入药品,打开活塞K,通入一段时间空气。
③分别称量装置C、D的质量(数据见下表)。
| 装置C的质量 |
装置D的质量 |
|
| 步骤③ |
292.4g |
198.2g |
| 步骤⑥ |
296.9g |
207.0g |
④关闭活塞K,点燃酒精灯,使碱式碳酸镁晶体完全分解。
⑤停止加热,同时打开活塞K,通入空气至恢复到室温。
⑥再次分别称量装置C、D的质量(数据见右表)。
【实验分析】
①装置A的作用为,装置D的作用为。
②反应后,装置B中的剩余固体是,质量为g。
③该碱式碳酸镁晶体[xMgCO3•yMg(OH)2•zH2O]中,x︰y︰z = (写最简整数比)。
下图中甲、乙、丙、丁是初中化学中常见的物质,均由两种或三种元素组成,其中甲是胃液中帮助消化的成分,乙俗称消石灰。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。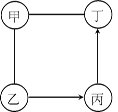
(1)写出乙在农业上的一种常见用途:。
(2)①若甲、乙、丙、丁为不同类别的物质,丁的化学式为。
②若丁是侯氏制碱法中制得的“碱”,丙转化为丁的化学方程式为。
③写出②中的丁转化为①中的丙的化学方程式:。
人类每年要提取数以亿吨计的金属,用于工农业生产和其他领域。
(1)汽车电路中一般用铜作导线,这是利用铜的;汽车车体表面喷漆不仅美观,而且可有效防止铁与接触而生锈。
(2)炼铁的原理是利用一氧化碳和氧化铁的反应,化学方程式为。
(3)某化工厂排出澄清的废水,其中可能含有的离子是Ba2+、Fe3+、Fe2+、Ag+、Cu2+、SO42-、Cl-、NO3-。[已知:白色的Fe(OH)2沉淀在空气中会迅速转化为红褐色的Fe(OH)3。]
①取少量废水,加入过量稀盐酸,产生白色沉淀的化学式为。过滤,将滤液分成两份,一份加入稀硫酸,产生白色沉淀的化学式为;另一份加入过量NaOH溶液,产生蓝色沉淀,该过程中与OH-反应的离子是(写离子符号)。
②某化学兴趣小组设计了一个处理该废水的实验方案,部分流程如下:
下列说法正确的是(填字母)。
| A.固体A中一定含有Ag和Cu,可能含有Fe |
| B.溶液B中的溶质有Ba(NO3)2、Fe(NO3)2 |
| C.废水中含有Ba2+、Ag+、Cu2+、Fe2+、NO3 |
| D.通过该流程可以除去废水中原有的金属离子 |
能源、环境与人类生活和社会发展密切相关。
(1)目前,人类以化石燃料为主要能源,常见的化石燃料包括煤、石油和。
(2)甲、乙两个城市全年雨水的月平均pH变化如图。下列说法正确的是(填字母)。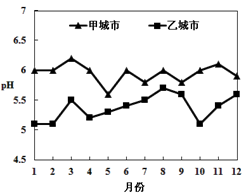
| A.甲城市受酸雨的影响较严重 |
| B.pH小于6的降雨称为酸雨 |
| C.煤的大量燃烧是造成酸雨的主要原因之一 |
| D.大力推广使用脱硫煤可以减少酸雨的形成 |
(3)二氧化氮进入大气后与雨水作用,可能形成硝酸型酸雨,硝酸的化学式为。氨气进入大气后与雨水作用,可能形成“碱雨”,“碱雨”中碱的化学式为。“碱雨”中的碱和硝酸发生中和反应生成一种可用作氮肥的铵盐,其化学式为。
(4)下图是某反应的微观示意图,通过该反应可以将氨气转化。若D为空气中体积分数最大的气体,则生成C和D的质量比为(写最简整数比)。