下列各组离子在溶液中能大量共存,加入OH-有沉淀生成,加入H+有气体生成的一组离子是
| A.K+、Mg2+、Cl-、HCO3- | B.K+、Cu2+、SO42-、Na+ |
| C.NH4+、CO32-、NO3-、Na+ | D.NH4+、Cl-、HCO3-、K+ |
在一定条件下,R 和氟气可发生如下反应:R
和氟气可发生如下反应:R +
+
F2+2OH-====R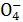 +2F-+H2O。从而可知在R
+2F-+H2O。从而可知在R 中,元素R的化合价是 ( )
中,元素R的化合价是 ( )
| A.+4 | B.+5 | C.+6 | D.+7 |
学生设计了下图所示的方法对A盐进行鉴定: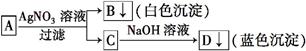
由此分析,下列结论中,正确的是 ( )
| A.A中一定有Fe3+ | B.C中一定有Cu2+ |
| C.B一定为AgCl沉淀 | D.A一定为CuCl2溶液 |
向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,溶液的导电性(以电流I表示)和滴入的稀硫酸的体积(用V表示)之间的关系正确的是 ( )
某无色透明的酸性溶液中能大量共存的一组离子是
A.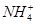 、 、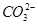 、Al3+、Cl- 、Al3+、Cl- |
B.Na+、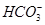 、K+、 、K+、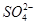 |
C.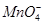 、K+、 、K+、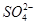 、Na+ 、Na+ |
D.Mg2+、Na+、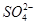 、 、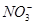 |
与离子方程式H++OH-====H2O相对应的化学方程式是 ( )
| A.Ba(OH)2+2HCl====BaCl2+2H2O |
| B.NaOH+NaHSO4====Na2SO4+H2O |
| C.Ba(OH)2+H2SO4====BaSO4↓+2H2O |
| D.NaOH+CH3COOH====CH3COONa+H2O |