将含有O2和CH4的混合气体置于盛有23.4gNa2O2的密闭容器中,不断用电火花点燃,反应结束后,容器内的压强为零(150℃),将残留物溶于水中,无气体产生。下列叙述正确的是
| A.原混合气体中O2和CH4的体积比为2∶1 | B.残留物只有Na2CO3 |
| C.原混合气体中O2与CH4的体积比为1∶1 | D.残留物只有Na2CO3和NaOH |
下列氯化物中,不能用金属和氯气反应得到的是
| A.CuCl2 | B.FeCl2 | C.MgCl2 | D.NaCl |
19世纪初,某科学家提出了原子学说,他认为物质由原子组成,原子不能被创造,也不能被毁灭,在化学反应中不能再分,这个科学家是
| A.汤姆生 | B.道尔顿 | C.卢瑟福 | D.波尔 |
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,下图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是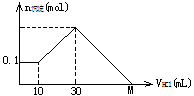
| A.70mL | B.100mL | C.120mL | D.130mL |
要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
| A.③① | B.③② | C.①③ | D.①②③ |
下列离子方程式正确的是
| A.醋酸与氢氧化钠溶液反应:CH3COOH+OH-→ CH3COO-+H2O |
| B.铁与盐酸反应:2Fe+6H+→ 2Fe3++3H2↑ |
| C.氯化铁溶液和氨水反应:Fe3++ 3OH-®Fe(OH)3↓ |
| D.氯化铝溶液中滴入过量氢氧化钠溶液:Al3+ + 3OH-® Al(OH)3↓ |