洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为: 。
(2)漂白粉的有效成分是 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(10分)化工厂生产的某产品只含C、H、O三种元素,分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。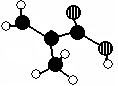
(1)该产品的结构简式为_______,所含官能团的名称:_____________
(2)该有机物的核磁共振氢谱上有________个峰(信号)
(3)下列物质中,与该产品互为同分异构体的是_____________(填序号,下同)与该产品互为同系物的是_____________。
①CH3CH=CHCOOH②CH2=CHCOOCH3 ③CH3CH2CH="CHCOOH" ④CH3CH(CH3)COOH
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100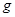 5.00%的NaOH溶液、足量的CuSO4溶液和l00
5.00%的NaOH溶液、足量的CuSO4溶液和l00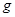 10.00%的K2SO4溶液.电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
10.00%的K2SO4溶液.电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题: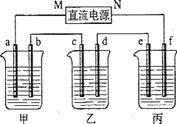
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③电极b上生成的气体在标准状况下的体积: ;﹙精确到小数点后一位小数﹚
④电极c的质量变化是增加 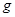 ;
;
(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈性,原因(用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:前者后者(填“>,<或=”)
新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,为检验其成分,某研究性学习小组做了如下实验,请根据所做实验,按要求填空。
(1)取少量新制氯水于试管中,加入碳酸钙粉末,发现有气泡产生,则说明起作用的成分是HCl,HCl表现出性。
(2)取少量新制氯水于试管中,加入AgNO3溶液,发现有白色沉淀产生,则起作用的是。
(3)取少量新制氯水于试管中,加入一块红纸,发现很快褪色,则起作用的是。
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是Cl2,说明氯气具有性。
将与“实验操作”相对应的“实验现象”的字母代号填入“答案”栏中。
| 实验操作 |
答案 |
实验现象 |
| (1)将浓硫酸滴在小木条上 |
A.产生白烟 |
|
| (2)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近 |
B.产生蓝色物质 |
|
| (3)在盛有KI淀粉溶液的试管中滴加氯水 |
C.溶液呈红色 |
|
| (4)在盛有FeC13溶液的试管中滴入2滴KSCN溶液 |
D.变黑色 |