取19.2g铜跟少量的浓硝酸反应,铜全部溶解后,收集到NO2、NO混合气体的体积11.2L(标准状况),反应消耗硝酸的物质的量是
| A.0.5mol | B.0.8mol | C.1.1mol | D.1.2mol |
下图是某分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。该分子是
| A.C2H5OH | B.CH3COOH | C.CH3CHO | D.C6H5OH |
下列反应属于取代反应的是
| A.乙烯通入酸性高锰酸钾溶液中 | B.苯与液溴混合后撒入铁粉 |
| C.在镍做催化剂的条件下,苯与氢气反应 | D.乙烯通入溴水中 |
11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88gCO2和45gH2O。则A的分子式为
| A. CH4 | B. C2H4 | C. C4H8 | D.C4H10 |
下列的晶体中,化学键种类相同,晶体类型也相同的是
| A.SO2与SiO2 | B.CO2与H2O | C.NaCl与HCl | D.CCl4与KCl |
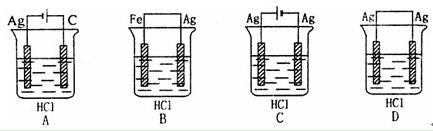
某学生欲完成反应2HCl+2Ag=2AgCl↓+H2↑设计了下列四个实验,你认为可行的是