金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取
Ti的反应为
aTiO2 + bCl2+eC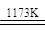 aTiCl4+eCO Ⅰ
aTiCl4+eCO Ⅰ
TiCl4+2Mg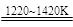 Ti+2MgCl2 Ⅱ
Ti+2MgCl2 Ⅱ
关于反应Ⅰ、Ⅱ的分析不正确的是
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;
②C、Mg在两个反应中均被还原;
③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b="e" =2
⑤每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移4.8 mol e-。
A.①②④ B.②③④ C.②⑤ D.③④
下列热化学方程式中的反应热下划线处表示燃烧热的是
A.NH3(g)+ O2(g) O2(g) NO(g)+ NO(g)+ H2O(g); ΔH=-a kJ·mol-1 H2O(g); ΔH=-a kJ·mol-1 |
B.C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l); ΔH=-b kJ·mol-1 6CO2(g)+6H2O(l); ΔH=-b kJ·mol-1 |
C.2CO(g)+O2(g) 2CO2(g); ΔH=-c kJ·mol-1 2CO2(g); ΔH=-c kJ·mol-1 |
D.CH3CH2OH(l)+ O2(g) O2(g) CH3CHO(l)+H2O(l);ΔH=-d kJ·mol-1 CH3CHO(l)+H2O(l);ΔH=-d kJ·mol-1 |
微粒甲与乙物质中微粒的转化关系如图所示:
微粒甲可能的组合是:①SiO2;②NH4+;③Al3+;④SO2;⑤Cl2;⑥Fe2+;⑦Mg2+
| A.①②③④⑤⑥⑦ |
| B.①②③④⑥ |
| C.②③④⑤⑥⑦ |
| D.②③④⑤⑦ |
将SO2通入BaCl2溶液至饱和,未见有沉淀,继续通入另一种气体X仍无沉淀,则X可能是
| A.CO2 | B.NH3 | C.NO2 | D.H2S |
一氯氨(NH2 Cl)中氨基带部分负电荷,预计它跟水反应的最初生成物是
| A.NH2OH和HCl | B.NH3·H2O和HCl |
| C.NH3和HClO3 | D.NH3和HClO |
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ。根据以上信息和数据,下列说法正确的是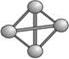
| A.N4不属于新型化合物 | B.N4与N2互为同位素 |
| C.N4沸点比P4(白磷)高 | D.一个N4的能量比一个N2的能量低 |