“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4 +□K2SO4+□
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的反应速率为 (保留小数点后二位数,下同)。
②实验2条件下平衡常数K= ,该反应为 (填“吸热”或“放热”)反应。
(3)已知在常温常压下:
①2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6 kJ/mol
②2CO (g)+ O2(g)=2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)=H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。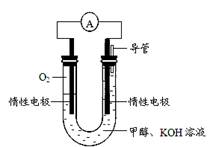
该电池正极的电极反应式为 ;该电池工作时,溶液中的OH-向 (填“正”或“负”)极移动。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。

(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
①A电极对应的金属是________(写元素名称),B电极的电极反应式是________________________。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
____________________________________________________
将1 L含有0.4 mol CuSO4和0.2 mol NaCl 的水溶液用惰性电极电解一段时间后。
(1)若在一个电极上得到0.1 mol Cu,另一电极上析出气体(在标准状况下)的体积是________ L。
(2)若在一个电极上恰好得到0.4 mol Cu,另一电极上再析出气体(在标准状况下)的体积是________ L。
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
(1)写出反应①的化学方程式:。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为。
(2)净化步骤所得滤饼的主要成分是。回收的洗涤液代替水配制电解液,目的是回收利用其中的。
(3)溶液Ⅰ的主要成分是。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是。
(4)将Co2O3还原成Co粉的化学反应方程式为。
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;
请回答下列问题:
(1)固体a的化学式为,Ⅲ中通入足量CO2气体发生反应的离子方程式为。
(2)由Ⅴ制取铵明矾溶液的化学方程式为,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为。