工业上生产电路板及处理废液的工艺流程如下:
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是________和________。
(2)步骤②加入过量的铁粉,除能与废液中FeCl3反应外,还可发生的化学反应方程式为______________________。
(3)步骤③加入稀盐酸,充分搅拌,当观察到________________________时,说明滤渣只剩铜。
(4)步骤②③所得FeCl2可与一种单质发生化合反应生成FeCl3,实现循环使用。根据质量守恒定律可推测该单质的化学式为___________。
据有关资料介绍:将贝壳(主要成分碳酸钙)灼热与草木灰(主要成分碳酸钾)在水中作用,可以得到氢氧化钾。某化学兴趣小组,为了制取氢氧化钾,将少量碳酸钙充分灼热后的固体放入烧杯中,再向其中加入一定量的10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B。请回答下列有关问题:
(1)取少量固体A于试管中,加入稀盐酸,有气泡产生,证明A中含有__________。
(2)取少量固体A于试管中,加水充分溶解、过滤,向滤液中滴加______________,溶液变红色,证明A中还含有氢氧化钙。
(3)结合(1)(2)固体A成分的确定,可以推断溶液B的成分有氢氧化钾和氢氧化钙。为了得到纯净的氢氧化钾,需向溶液B中滴加适量的_____________溶液,发生反应的化学方程式为____________________________________________,充分反应后过滤,将滤液蒸干可制得较纯净的氢氧化钾。
A~E为初中化学中常见的物质,其中A能使带火星的木条复燃,E的浓溶液能使小木棒变黑。它们的反应转化关系如下图所示(图中部分生成物未标出)。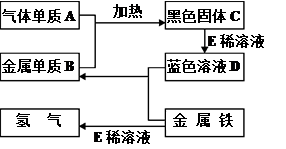
(1)单质A和B的化学式:A__________;B___________。
(2)固体C与E稀溶液反应的化学方程式____________________________________。
(3)金属铁与蓝色溶液D反应的化学方程式__________________________________。
有一包白色固体,可能由CaCl2、K2CO3、Na2SO4、NaCl中一种或几种组成,为确定其组成进行如下实验:
(1)将固体溶于水得无色溶液,说明和只有一种存在。
(2)向溶液中滴加足量Ba(NO3)2溶液,有白色沉淀产生,说明可能有或。
(3)过滤后向白色沉淀中加入稀硝酸,白色沉淀消失,向滤液中滴加硝酸银溶液,有白色沉淀产生,说明一定有存在。故此固体是由
组成的混合物。
某校兴趣小组在我市某地收集到两种岩石样品A和B。他们进行了如下实验探究(B是常用的建筑材料,H是单质,图中部分产物被略去):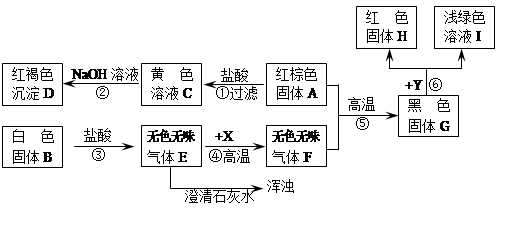
(1)写出有关物质的化学式:
A的主要成分,B的主要成分,X是。
(2)写出图中下列步骤的化学方程式:
②;⑤。
(1)下列有关初中化学常见物质及相互转化,都与人类生活有密切关系,其中A、B、M均为常见单质,E为难溶于水的白色沉淀,F为最简单的有机物。
①一定量的A在B中点燃可生成C和D的混合物,且C、D均为无色气体,C有剧毒。
② M+B→G(此反应是获取能量的最清洁反应)
③ D+L→E+G
写出E的化学式:E;写出固态D的俗称。
转化③的化学方程式。
F在B中充分燃烧的化学方程式。
(2)现有铁、氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液五种物质,存在如图所示的相互反应和转化关系。图中“——”表示两端的物质间可以发生化学反应,“→”表示物质间存在相应的转化关系。下列判断合理的是。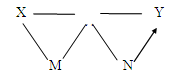
A.X一定是碳酸钠溶液
B.Y一定是稀盐酸
C.N转化为铁的反应都属于置换反应
D.X、Y、M两两之间都可以发生复分解反应