X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20,下列判断正确的是
| W |
X |
Y |
| |
Z |
|
A.四种元素的原子半径:rZ>rX>rY>rW
B.四种元素形成的单质最多有6种
C.四种元素均可与氢元素形成电子总数为18的分子
D.四种元素中,Z的最高价氧化物对应的水化物酸性最强
二氟甲烷是性能优异的环保产品,它可替代某些会破坏臭氧层的“氟里昂”产品,用作空调、冰箱和冷冻库的制冷剂。试判断二氟甲烷的结构简式有
| A.有4种 | B.有3种 | C.有2种 | D.只有1种 |
在检验SO42-的过程中,下列操作中正确的是
| A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42- |
| B.先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42- |
| C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42- |
| D.先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42- |
如图是一种试验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是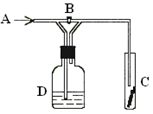
| A.浓H2SO4 | B.饱和NaCl溶液 |
| C.浓NaOH溶液 | D.浓NaBr溶液 |
将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入气体可能是
| A.CO2 | B.NH3 | C.NO2 | D.Cl2 |
除去乙烷中混有的少量乙烯,应采用的简便方法是
| A.将混合气体通过氢氧化钠溶液 |
| B.将混合气体通过溴水 |
| C.将混合气体在催化剂条件下跟氢气反应 |
| D.将混合气体通过酸性KMnO4溶液 |