下列图中的实验方案,能达到实验目的的是
| |
A |
B |
C |
D |
| 实验 方案 |
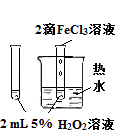 |
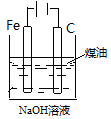 |
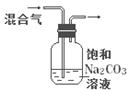 |
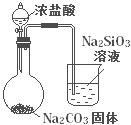 |
| 实验 目的 |
验证FeCl3对H2O2分解反应有催化作用 |
制备Fe(OH)2并能较长时间观察其颜色 |
除去CO2气体中混有的SO2 |
比较HCl、H2CO3和H2SiO3的酸性强弱 |
下列有关描述中正确的是
| A.常温下硝酸铵溶于水是一个能自发进行的吸热过程,说明该过程的△S>0 |
B.反应 A(g)+3B(g)  2C(g)达平衡后,升高温度,平衡常数增大,则正反应的△H<0 2C(g)达平衡后,升高温度,平衡常数增大,则正反应的△H<0 |
| C.已知H+(aq) + OH- (aq) = H2O(l);△H =" -57.3" kJ/mol。将4 g氢氧化钠固体放入100 mL 1 mol/L的稀盐酸中,放出了5.73 kJ的热量 |
| D.检验C2H5Cl中的氯元素:先将C2H5Cl与NaOH溶液混合后加热,冷却后再AgNO3溶液 |
NA为阿伏加德罗常数的值,下列叙述正确的是
| A.等物质的量的N2和CO所含分子数均为NA |
| B.1.7gH2O2中含有的电子数为0.9NA |
| C.10mL质量分数98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
| D.1molCl2与足量的铁反应,转移的电子数为3NA |
X﹑Y﹑Z﹑M是元素周期表中前20号元素,其原子序数依次增大,且X﹑Y﹑Z相邻。X 的核电荷数是Y 的核外电子数的一半,Y与M可形成化合物M2Y。则下列说法正确的是
| A.还原性: X的氢化物﹥Y的氢化物﹥Z的氢化物 |
| B.简单离子的半径:M的离子>Z的离子 >Y的离子>X的离子 |
| C.YX2﹑M2Y都含有极性键 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |
已知:
(1)胆矾失水的热化学方程式为:CuSO 4 ·5H 2O(s)=CuSO 4 (s)+5H 2O(l) Δ H=+Q1 kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:CuSO 4 (s)=Cu 2+(aq)+SO 42-(aq) Δ H =-Q 2 kJ·mol-1
(3)胆矾(CuSO 4 ·5H 2 O)溶于水时溶液温度降低。则 Q1与 Q2的关系是( Q 1、Q2为正数)
| A.Q1 > Q 2 | B.Q1= Q 2 | C.Q1 < Q 2 | D.无法确定 |
有关下列离子方程式的说法正确的是
A.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH- NH3↑+H2O NH3↑+H2O |
| B.向NaAlO2溶液中通入过量CO2的反应为:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32— |
| C.等物质的量的FeBr2与Cl2反应为:2Fe2++2Br—+2Cl2=2Fe3++Br2+4Cl— |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4— + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O |