关于如图所示①、②两个装置的评价正确的是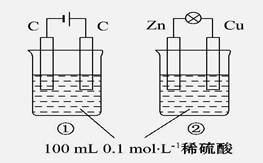
| 选择 |
叙 述 |
评价 |
| A |
装置名称:①电解池,②原电池 |
错误 |
| B |
硫酸浓度变化:①增大,②减小 |
错误 |
| C |
电极反应式 ②正极:Zn-2e-====Zn2+ :①阳极:4OH--4e-====2H2O+O2↑ |
正确 |
| D |
离子移动方向:①H+向阴极移动 ②H+向正极移动 |
正确 |
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4FeO·Cr2O3 + 8Na2CO3 + 7O2 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
(2)2Na2CrO4 + H2SO4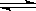 Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
下列说法正确的是
| A.反应(1)和(2)均为氧化还原反应 |
| B.反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3 |
| C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D.反应(1)中每生成1molNa2CrO4时电子转移3mol |
下列离子方程式正确的是
A.向NH4HSO3溶液中,加入过量的氢氧化钠溶液,并加热 NH4++OH- NH3↑+H2O NH3↑+H2O |
| B.向FeBr2溶液中通入过量氯气 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| C.向次氯酸钠溶液中通入少量SO2气体 2ClO- + SO2 + H2O =" 2HClO" + SO32- |
D.实验室制氯气 MnO2 + 4H+ + 2Cl- Mn2+ + Cl2 ↑+2 H2O Mn2+ + Cl2 ↑+2 H2O |
向含下列离子的各组溶液中,分别加入Na2O2后,还能大量共存的一组是
| A.NH4+、Ca2+、NO3-、Cl- | B.K+、Mg2+、HCO3-、MnO4- |
| C.Na+、Ba2+、Cl-、I- | D.K+、Na+、CO32-、SO42- |
已知向某溶液中逐滴加入NaOH溶液时,测得生成沉淀的质量随所加入NaOH的体积变化如图所示,则该溶液中大量含有的离子可能是
| A.H+、NH4+、Al3+、NO3- | B.H+、Al3+、AlO2-、SO42- |
| C.H+、NH4+、Mg2+、Cl- | D.NH4+、Al3+、Cl-、SO42- |
如图所示等质量C2H6与X气体在相同温度下的密闭容器中,压强(P)与体积(V)的关系,则X气体可能是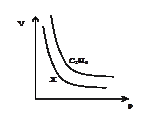
| A.H2 | B.NO | C.C2H2 | D.HCl |