元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为
(3)已知:
| 化合物 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
| 熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时的反应方程式是 ;制铝时,电解Al2O3不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的:
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
一定条件下向容积为20 L的密闭容器中充入1 mol NO2气体,发生反应2NO2  N2O4。反应中测得相关数据如下表所示:
N2O4。反应中测得相关数据如下表所示:
| 反应时间/min |
0 |
10 |
20 |
30 |
40 |
50 |
| 气体相对分子质量 |
46 |
57 |
64 |
69 |
69 |
69 |
(1)此条件下该反应的化学平衡常数Kc=________。(填表达式)
(2)在50 min末,向容器中加入 mol NO2,若要保持平衡不发生移动,则应加入N2O4________mol。
(3)若保持容器体积不发生变化,升高温度,则可得如图图像,据此判断该反应ΔH________0(填“大于”、“小于”或“等于”)。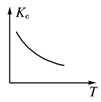
(4)若在体积不变的情况下,开始充入0.5 mol N2O4,则达到新平衡时N2O4的转化率α=________。
在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应
PH4I(S) PH3(g) + HI(g)①;
PH3(g) + HI(g)①;
4PH3(g)  P4(g)+ 6 H2(g)②;
P4(g)+ 6 H2(g)②;
2HI(g) H2(g) + I2(g)③
H2(g) + I2(g)③
以上三反应建立平衡后,测得HI为b mol,I2(气)为c mol,H2为d mol。求:
⑴平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):n(P4)=,n(PH3)=。
⑵ a,b,c三者的关系服从a >(填含b,c的代数式)。
⑶平衡后,增大压强,容器内n(I2), n(PH4I)(增加、减少、不变)
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(右图中的△H表示生成1mol产物的数据)。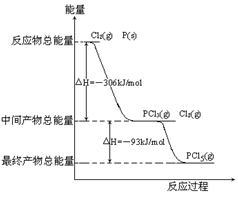
(1)P和Cl2反应生成PCl3的热化学方程式_____________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________________,
(3)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4__________△H3(填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_________________。
在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图10-1)。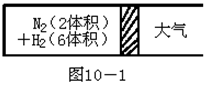
容器中发生如下反应:N2+3H2  2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
⑴保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。那么:①a=1,c=2,则b==。在此情况下,反应起始时将向方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是。
⑵在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是,原因是________________________________ 。
现有可逆反应.2NO2(g) N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
t2:;
t3:;
t4:。