A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。
(1)A在周期表位置________写出一种工业制备单质F的离子方程式:___________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为_______其水溶液与F单质反应的化学方程式为__________________________________.
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 |
组成和结构信息 |
| a |
含有A的二元离子化合物 |
| b |
含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c |
化学组成为BDF2 |
| d |
只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;
c的电子式为________, d是________晶体
(4)由A和B元素组成的二元化合物是 沼气的主要成分,其与氧气在酸性电解质溶液中组成燃料电池消耗标况下11.2L氧气时转移电子数为__________mol。
命名下列有机物
(1)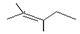 (2)
(2)
(3)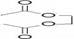 (4)
(4)
根据下面的有机物合成路线回答下列问题: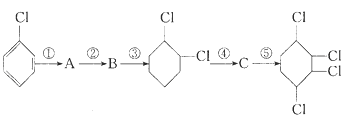
(1)写出A、B、C的结构简式:A:__________,B:__________,C:__________。
(2)各步反应类型:①______,②______,③______;④_______,⑤________。
(3)A→B的反应试剂及条件___________________________。
下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。
填写下列空白:(注:溴苯与NaOH溶液不可以发生水解反应)
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所有反应的化学方程式___________________________。
(2)试管C中苯的作用是________________;反应开始后,观察D和E试管,看到的现象为D中___________;E中 ;
(3)在上述整套装置中,具有防倒吸的仪器有___________________(填字母)
(4)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点是_______________。
根据题干要求回答下列问题
(1)用系统命名法给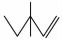 命名为:_________________;写出该物质与HBr反应的化学方程式:_________________
命名为:_________________;写出该物质与HBr反应的化学方程式:_________________
(2)2丁烯合成聚2丁烯的方程式为:_________________________
(3)实验室制乙烯的反应方程式:______________________________
2-甲基-1,2-丁二醇的催化氧化方程式: __________________________
25℃时,几种酸的电离平衡常数如下:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.8×10-5 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol/L的下列四种溶液:A.Na2CO3溶液,B.NaClO溶液,C.CH3COONa溶液,D.NaHCO3溶液,pH由大到小的顺序是____________(填编号)。
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程中,下列各项的数值一定变小的是_______________。
A.c (H+)B.c (H+) / c (CH3COOH)
C.c (H+)·c(OH-) D.c(OH-) / c (H+)
(3)体积均为10 mL pH均为2的CH3COOH溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图。稀释后,HX溶液中水电离出来的c(H+)__________(填“大于”、“等于”、“小于”)CH3COOH溶液中水电离出来的c(H+),理由是____________________。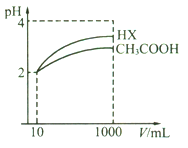
(4)25℃时,测得CH3COOH与CH3COONa的混合溶液pH=6,则溶液中c(CH3COO-)-c(Na+)=___________(填准确数值)。