将6molA和2molB在2L的密闭容器中混合并在一定条件下发生如下反应:3A(g)+B(S) 2C(g) ΔH<0,4s(秒)后反应达到平衡状态,此时测得C的浓度为1mol·L-1,下列说法中正确的是
2C(g) ΔH<0,4s(秒)后反应达到平衡状态,此时测得C的浓度为1mol·L-1,下列说法中正确的是
A.4s内用物质B表示的反应速率为0.125mol·L-1·S-1
B.达到平衡后若向容器中通入惰性气体,则A的转化率增大
C.此时,A、B、C的物质的量之比为3:1:2
D.达平衡后若升高温度,C的浓度将增大
下列各组性质比较中,正确的是()
①酸性:HClO4>HBrO4>HIO4②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F>C>O④还原性:Cl<S<Si
⑤气态氢化物稳定性:HF>HCl>H2S
| A.①②③ | B.②③④ | C.①②④⑤ | D.①②③④⑤ |
镍氢电池的总反应式是 H2+2NiO(OH)  2Ni(OH) 2根据此反应式判断,此电池放电时,负极上发生反应的物质是()
2Ni(OH) 2根据此反应式判断,此电池放电时,负极上发生反应的物质是()
| A.NiO(OH) | B.Ni(OH) 2 | C.H2 | D.H2和NiO(OH) |
阴离子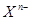 含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
A.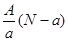 mol mol |
B.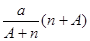 mol mol |
C.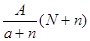 mol mol |
D.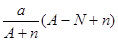 mol mol |
下列说法正确的是()
| A.决定化学反应速率的主要因素是参加反应的物质的性质 |
| B.催化剂可以使不起反应的物质发生反应 |
| C.可以找到一种催化剂使水变成油(油的成份为碳氢化合物的混合物) |
| D.催化剂是决定化学反应速率的主要因素 |
对于反应A2+3B2=2C来说,以下表示中,反应速率最快的是()
A. v(B2)="0.8" mol/ (L·s) B. v(A2)="0.4" mol/ (L·s)
C. v(C)="0.6" mol/ (L·s) D. v(B2)="1.8" mol/ (L·s)