液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s) 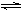 NH3(g) + HI(g)
NH3(g) + HI(g)
b.2HI(g) 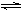 H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式
②达到平衡后,扩大容器体积,反应b的移动方向 (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g) 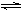 2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据: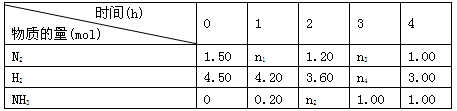
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因 。
把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是
Ca2++2OH-下列说法正确的是
| A.恒温下向溶液中加CaO,溶液的pH升高 |
| B.给溶液加热,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,其中固体质量增加 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
常温下某溶液中,由水电离出的c(H+)为1×10—12mol/L,该溶液中一定能大量共存的离子组是
| A.K+、Na+、SO42—、NO3— | B.Na+、K+、ClO—、CO32— |
| C.Fe2+、Mg2+、Cl—、SO42— | D.NH4+、Cl—、K+、SO32— |
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U形管)构成一个原电池(如右图)。以下有关该原电池的叙述正确的是
①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③盐桥中K+移向CuSO4溶液
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
| A.①② | B.③④ | C.①②④ | D.①②③④ |
列关于化学电源的叙述错误的是
| A.铅蓄电池中覆盖着PbO2的电极板是负极板 |
| B.普通锌锰干电池中碳棒为正极 |
| C.氢氧燃料电池的正极是通入氧气的那一极 |
| D.碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高 |
下列溶液中有关粒子的物质的量浓度关系正确的是
A.氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO)
B.25℃时,pH=12的NaOH溶液与pH=12的氨水:c (Na+ ) = c(NH4+ )
C.pH=4的0.1 mol·L-1的NaHA溶液中:c (HA-) > c (H+ ) > c (H2A) > c (A2- )
D.在K2CO3溶液中:c (CO32- ) + c (OH- ) = c (HCO3- ) + c( H+ )