(13分)天然气的主要成分是甲烷,它是一种重要的燃料和基础化工原料。
(1)以甲烷和水为原料可制取甲醇。
①CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ/mol
CO(g)+3H2(g) △H=+206.0kJ/mol
②CO(g)+2H2(g) CH3OH(g) △H=—129.0kJ/mol
CH3OH(g) △H=—129.0kJ/mol
则CH4(g)+H2O(g) CH3OH(g)+H2(g)的△H=__________kJ/mol。
CH3OH(g)+H2(g)的△H=__________kJ/mol。
(2)用甲烷催化还原NOx为N2可消除氮氧化物的污染,写出反应的化学方程式_______。
(3)一定条件下,反应CH4(g)+H2O(g) CO(g)+3H2(g)可以制取合成氨的原料气H2。将1.0mol CH4和2.0 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度的关系如图。已知100℃时达到平衡所需的时间是5min,则用H2表示的反应速率v(H2)=___________;该温度时的平衡常数K=__________,该反应的△H_______0(填“<”、“>”或“=”)。
CO(g)+3H2(g)可以制取合成氨的原料气H2。将1.0mol CH4和2.0 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度的关系如图。已知100℃时达到平衡所需的时间是5min,则用H2表示的反应速率v(H2)=___________;该温度时的平衡常数K=__________,该反应的△H_______0(填“<”、“>”或“=”)。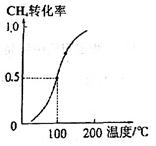
(4)某化学小组设计如图装置进行饱和NaCl溶液电解实验。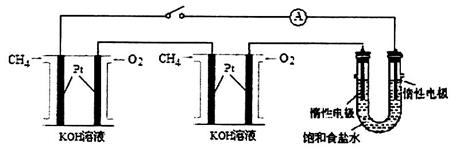
请回答下列问题:
已知每个甲烷燃料电池中盛有1.0L2.0 mol/L的KOH溶液。标准状况下,当每个燃料电池的负极通入甲烷的体积均为33.6L,且反应完全,则理论上电池溶液中c(K2CO3)_______c(KHCO3)(填“<”、“>”或“=”):最多能产生标准状况氯气的体积为________L。
(12分)有5种烃:甲烷、乙炔、苯、环己烷、甲苯,分别取一定质量的这些烃完全燃烧后生成mmol CO2和nmol H2O。
(1)当m=n时,该烃是__________________。
(2)当m=2n时,该烃是__________________。
(3)当2m=n时,该烃是__________________。
(4)当4m=7n时,该烃是__________________。
(10分)(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯类化合物 |
相对速率 |
| (CH3)2C==CHCH3 |
10.4 |
| CH3CH==CH2 |
2.03 |
| CH2="=" CH2 |
10.0 |
| CH2==CHBr |
0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C==C上取代基的种类、个数间的关系:____________________________________。
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是_________。
| A.(CH3)2C==C(CH3)2 |
| B.CH3CH==CHCH3 |
| C.CH2="=" CH2 |
| D.CH2==CHCI |
随着科学技术的发展,人们对物质微观结构的认识不断深入。下图是NaCl晶体
的结构示意图,该晶体中阴离子的堆积方式为_______________。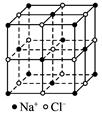
(1)已知阿伏加德罗常数的值(Na),X射线测得NaCl晶体中靠得最近的Na+、Cl-间的平均距离为a cm,则NaCl晶体的密度为_______________g·cm-3。
(2)某化学课外小组尝试在实验室中测定NaCl晶体的密度,其实验方案如下:先将固体NaC
l研细,准确称量mgNaCl粉末并转移到容积为100 mL的定容仪器A中。然后,向A仪器中
滴加苯,并不断振荡,至恰好达到刻度线时,测得加入苯的体积为V mL。
①定容仪器A最好选用______________________________ (填仪器名称)。
②能否用水代替苯_______________ (填“能”或“不能”);其理由是____________________。
③向仪器A中滴加苯时要不断振荡的目的是_______________________________________。
④使用该方法测得NaCl晶体的密度为_______________g·cm-3。
将白净细砂与镁混合,灼烧到反应物转化为灰黑色的化合物A 和白色反应物B(均只由两种元素组成)后,冷却,再向其中滴加盐酸,立即有气体逸出,并迅速自燃,据此推测出化合物A和B的化学式。写出有关化学方程式。
近年来,科学家在氦的气氛中给石墨电极通电,石墨挥发,在其挥发的黑烟中发现了C60,它与金刚石互称。它是一种具有空心类似足球状结构的新分子,碳原子之间存在键,它的摩尔质量是,而金刚石是一种结构的晶体,碳原子间通过键结合,含有碳原子构成的环,则最小环上有(填数字)个碳原子,每个碳原子上的两个碳碳键的夹角都是(填角度)。