稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.电解熔融CeO2制Ce,铈在阳极获得 |
B.铈有四种稳定的核素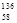 Ce、 Ce、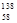 Ce、 Ce、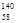 Ce、 Ce、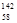 Ce,它们互为同素异形体 Ce,它们互为同素异形体 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
| D.由于氧化性:Ce4+>Fe3+,而I—有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+8HI=2CeI4+4H2↑。 |
2015年11月世界气候大会再次提出全球变暖的问题。下列物质属于温室气体的是()
| A.SO2 | B.NO2 | C.O2 | D.CO2 |
某温度下,水的离子积Kw=1×10-13,则该温度下,pH=12的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=10,则强碱与强酸的体积比是
| A.11﹕1 | B.9﹕1 | C.1﹕11 | D.1﹕9 |
25°C时某些弱酸的电离平衡常数Ka如下表,下列说法正确的是
| A.相同pH的三种酸溶液,物质的量浓度由大到小的顺序为:c(HClO)>c(CH3COOH)>c(H2CO3) |
| B.在相同物质的量浓度的Na2CO3、NaClO、NaHCO3与CH3COONa四种钠盐中加水稀释,水解程度均增大,碱性均增强 |
| C.等物质的量浓度的NaClO和NaHCO3混合溶液中:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO |
下列各组离子在溶液中能够大量共存的是
| A.Na+、Al3+、Cl-、HCO3- |
| B.使pH试纸显蓝色的溶液:K+、Cu2+、Cl-、SO42- |
| C.滴入甲基橙指示剂呈红色的溶液:Na+、NH4+、ClO4-、NO3- |
| D.水电离出的c(H+)=1×10-13mol/L的溶液:K+、NH4+、SO32-、Cl- |
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是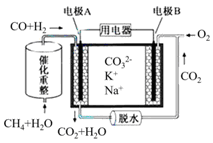
A.反应CH4+H2O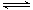 3H2+CO,每消耗1molCH4转移12mol电子 3H2+CO,每消耗1molCH4转移12mol电子 |
| B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |