某离子反应涉及H2O、ClO—、IO3—、OH—、I2、Cl—六种微粒。其中c(ClO—)随反应进行逐渐减小。下列判断错误的是
| A.该反应的还原剂是I2 |
| B.氧化剂与还原剂的物质的量之比为5:2 |
| C.消耗1 mol氧化剂,转移2 mol电子 |
| D.反应后溶液的碱性明显减弱 |
铁、铜混合粉末18.0 g 加入到100 mL 5.0 mol/LFeCl3溶液中,剩余固体质量为3.2 g。下列说法 正确的是
| A.剩余固体是铁、铜混合物 |
| B.原固体混合物中铜的质量是 9.6 g |
| C.反应后溶液中 n(Fe3+)="0.10" mol |
| D.反应后溶液中 n(Fe2+)+ n(Cu2+)="0.5" mol |
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是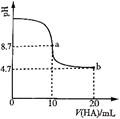
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A—)> c(HA)
D.pH=7时,c(Na+)= c(A—)+ c(HA)
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g)ΔH>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g)ΔH>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s |
0 |
500 |
1000 |
1500 |
| c(N2O5)/mol/L |
0.50 |
0.35 |
0.25 |
0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L
在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是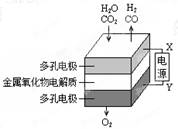
| A.X是电源的负极 |
| B.阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ |
| C.阴、阳两极生成的气体的物质的量之比是1︰1 |
D.总反应可表示为:H2O+CO2 H2+CO+O2 H2+CO+O2 |
下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法不正确的是
| A.X、W、Z元素的气态氢化物的热稳定性依次递减 |
| B.液态WX3气化需克服分子间作用力 |
| C.根据元素周期律,可以推测T元素的单质具有半导体特性 |
| D.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 |