亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生。它的部分性质见下图,
下列说法错误的是
| A.上图所涉及到的化学反应都是氧化还原反应 |
| B.N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键 |
| C.NaNO2与N2H4生成NaN3的反应方程式为:NaNO2 + N2H4 = NaN3 + 2H2O |
| D.可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2) |
下列叙述中正确的是( )
| A.SiO2和NO2能与强碱溶液反应,都是酸性氧化物 |
| B.不锈钢材料因含有铬、镍所以抗腐蚀性好 |
| C.普通玻璃、钢化玻璃、玻璃钢都属于硅酸盐产品,水玻璃可用于木材防腐 |
| D.MgO和A12O3熔点较高都可以做耐火材料,都能和强碱溶液反应 |
下列有关海水综合利用的说法正确的是( )
| A.电解饱和食盐水可制得金属钠 | B.海水提溴涉及到氧化还原反应 |
| C.海带提碘只涉及物理变化 | D.海水提镁不涉及复分解反应 |
下列实验操作或仪器使用正确的是( )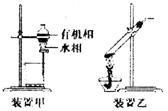
A.容量瓶、分液漏斗和滴定管都需要验漏
B.用装置甲分液,放出水相后再从分液漏斗下口放出有机相
C,用装置乙加热分解NaHCO3固体
D.配制500mL0.1mol·L‑1NaCl溶液用到的玻璃仪器只有500 mL容量瓶、烧杯和玻璃棒
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作太阳能电池材料和电脑芯片。下列叙述正确的是( )
| A.原子半径由大到小的顺序:W>Z>Y>X,简单离子半径由大到小的顺序:X>Y>Z |
| B.原子最外层电子数由多到少的顺序:Y>X>W>Z,最高正价由高到低顺序:W>Z |
| C.元素非金属性由强到弱的顺序:Z>W>X,W的单质常温下可与氢氧化钠溶液反应 |
| D.简单气态氢化物的稳定性由强到弱的顺序:X>Y>W |
从下列事实所列出的相应结论正确的是( )
| 实验事实 |
结论 |
|
| ① |
铜生的锈是绿色的称为铜绿 |
铜绿是致密的氧化膜 |
| ② |
浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 |
都发生了氧化还原反应 |
| ③ |
少量CO2通入Na[Al(OH)4]溶液产生白色沉淀和Na2CO3 |
酸性:HCO3->Al(OH)3 |
| ④ |
某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味的气体,该溶液滴加CaCl2溶液,有白色沉淀现象 |
确定该溶液存在CO32- |
| ⑤ |
某无色溶液加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有NH4+ |
A.②③⑤ B.①②③ C.③④⑤ D.全部