根据下表信息,下列判断正确的是
| 酸 |
电离常数(常温下) |
| CH3COOH |
Ki=1.8×10-5 |
| H2CO3 |
Ki1=4.3×l0-7, Ki2= 5.6×10-11 |
| H2S |
Ki1= 9.1×10-8, Ki2= 1.1×10-12 |
A.0.10mol/L的下列各溶液pH:Na2S<Na2CO3
B.HCO3-+CH3COOH→H2O+CO2↑+CH3COO-
C.硫化钠溶液可以与碳酸氢钠溶液反应
D.pH相同的CH3COOH、H2CO3、H2S,溶液浓度依次减小
某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质。为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法的是
| A.起始滤液常温下pH = 7 | B.试剂Ⅰ为 Ba(NO3)2溶液 |
| C.上图过程须经2次过滤 | D.步骤③目的是除去 CO32- |
下列关于下图所示电化学装置的分析正确的是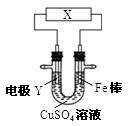
| A.若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜 |
| B.若X为直流电源,Y为碳棒接负极,则Fe棒被保护 |
| C.若X为电流计,Y为锌棒,则SO42- 移向Fe棒 |
| D.若X为导线,Y为铜棒,则Fe棒发生还原反应 |
下列说法不正确的是
| A.仅用酸性高锰酸钾溶液可区分苯和甲苯 |
| B.仅用氯化铁溶液可区分苯酚稀溶液和甘油 |
| C.仅用硝酸银溶液可验证卤代烃中卤原子的种类 |
| D.仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |
下列叙述正确的是
| A.氢氧化铝、碳酸钠都是常见的胃酸中和剂 |
| B.长期摄入肉、蛋、鱼偏多易导致血液偏酸性 |
| C.碘酒中的碘因有还原性而起到杀菌消毒作用 |
| D.碘盐、铁强化酱油等营养强化剂适合所有人食用 |
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应: 。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物的投入量 |
3 molH2、2 molN2 |
6 molH2、4 molN2 |
2 molNH3 |
| 达到平衡的时间/min |
5 |
8 |
|
| 平衡时N2的浓度/ mol·L-1 |
c1 |
1.5 |
|
| NH3的体积分数 |
φ1 |
φ2 |
|
| 混合气体的密度/g·L-1 |
ρ1 |
ρ2 |
下列说法不正确的是
A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1
B.在该温度下甲容器中反应的平衡常数
C.2c1<1.5
D.2ρ1=ρ2