下列有关热化学方程式的叙述中,正确的是
| A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为 NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.4 kJ/mol |
| B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则H2的燃烧热为241.8 kJ/mol |
| D.已知2C(s)+2O2(g)===2CO2(g) ΔH1,2C(s)+O2(g)==="2CO(g)" ΔH2;则ΔH1<ΔH2 |
将同温同压下的NO、NO2、O2三种气体按以下体积比混合后通入水中,气体不能完全溶于水的是
| A.1∶2∶1 | B.1∶1∶1 | C.5∶1∶4 | D.6∶2∶5 |
操作1:将1 L 1.00 mol·L-1的Na2CO3溶液逐滴加入到1 L 1.25 mol·L-1的盐酸中;操作2:将1 L 1.25 mol·L-1的盐酸逐滴加入1 L 1.00 mol·L-1的Na2CO3溶液中,两次操作产生的气体体积之比(同温同压下)是
| A.5∶2 | B.2∶5 | C.1∶1 | D.2∶1 |
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为
aTiO2 + bCl2+eC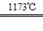 aTiCl4+eCO Ⅰ
aTiCl4+eCO Ⅰ
TiCl4+2Mg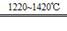 Ti+2MgCl2Ⅱ
Ti+2MgCl2Ⅱ
关于反应Ⅰ、Ⅱ的分析不正确的是
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;②C、Mg在两个反应中均被还原;
③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b="e" =2 ⑤每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移4.8 mol e-。
A.①②④B.②③④C.③④D.②③⑤
已知:还原性HSO3¯>I¯,氧化性IO3¯> I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3
溶液。加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是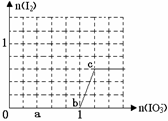
| A.0~b间反应:3HSO3-+ IO3-= 3SO42-+ I-+ 3H+ |
| B.a点时消耗NaHSO3的物质的量为1.2 mol |
| C.b~c间反应:I2仅是氧化产物 |
| D.当溶液中I¯与I2的物质的量之比为5∶2时,加入的KIO3 为1.08mol |
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是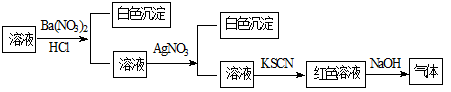
| A.原溶液中一定含有SO42-离子 | B.原溶液中一定含有NH4+离子 |
| C.原溶液中一定含有Cl-离子 | D.原溶液中一定含有Fe3+离子 |