H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)请写出H2O2的电子式 。
(2)H2O2分解过程的能量变化如图(a)所示,
试判断该反应为 反应(吸热或放热)。
①已知:Fe3+催化H2O2分解的机理可分两步反应进行,
第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+,
完成第二步反应的离子方程式: Fe2++
Fe2++  H2O2 +
H2O2 +  _________ ="="
_________ ="="  _________+
_________+  _________
_________
②按图(b)装置(A、B瓶中已充有NO2气体,2NO2(g)  N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。
N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。
(3)空气阴极法电解制备H2O2的装置如图(c)所示,主要原理是在碱性电解质溶液中,利用空气中O2在阴极反应得到H2O2和稀碱的混合物。
试回答:
①电源a极的名称是 。
②写出阴极电极反应式 。
(4)用H2O2和H2SO4的混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式 ,控制其它条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| Cu的平均溶解速率 (×10-3mol·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性、B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水电离程度小于A2溶液中水电离程度,B1溶液中水电离程度小于B2溶液中的水电程度。
(1)写出化学式:Al :____;A2:___;Bl :___;B2:____
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为________
(3)写出0.l mol·L-1的A2溶液中离子浓度的大小排列______。
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是___________。
(5)若常温下B1、B2两溶液的pH = 5,则两溶液中水电离出的氢离子的物质的量浓度之比为_______。
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO 浓度如下表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K =______。
(2)前2s 内的平均反应速率v(CO2)=________。
(3)在上述条件下反应能够自发进行,则反应的△H___0(填写“>”、“<”、“=”)。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是____
A.反应混合物各组分物质的量浓度相等
B. NO 、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗lmolNO的同时,就有lmolCO生成
下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1CH3COONa 溶液,并分别放置在盛有水的烧杯中,
然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1CH3COONa溶液显浅红色的原因为(用离子方程式表达)________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是______。
| A.水解反应为放热反应 |
| B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 |
| D.NH4NO3溶于水时吸收热量 |
(3)向0.01 mol·L-1CH3COONa溶液中分别加入NaCl固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为___________、______、_________。(填“左”、“右”或“不移动”)
如图所示,在不同的电解质溶液中可以组成不同的电池。
(1)①当电解质溶液为稀硫酸时,Fe电极是_____ (填“正”或“负”)极.其电极反应式为______
②当电解质溶液为NaOH溶液时,Al电极是____(填“正”或“负”)极.其电极反应式为______
(2)若把铝改为钢.电解质溶液为浓硝酸,则Fe 电极是_____(填“正”或“负”)极.其电极反应式为______。
过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态.如图I是1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图。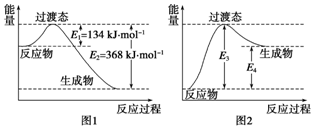
(1)试写出NO2和CO反应的热化学方程式:____.该反应的活化能是___kJ·mol-1
(2) 图2 是某学生模仿图l画出的NO(g)+CO2(g)= NO2(g)十CO(g)的能量变化示意图。则图中E3=_kJ·mol-1,E4="____" kJ·mol-1