短周期主族元素X、Y、Z、W的原子序数依次增大。X与W同主族,X、W的单质在标准状况下的状态不同。Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构。下列说法正确的是
| A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B.元素Y的简单气态氢化物的热稳定性比Z的强 |
| C.由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 |
| D.化合物X2Z2与W2Z2所含化学键类型完全相同 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应
A(g)+xB(g) 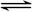 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确是
| A.30min时降低温度,40min时升高温度 |
| B.8min前A的平均反应速率为0.08mol/(L·min) |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.20min~40min间该反应的平衡常数均为4 |
已知25℃时有关弱酸的电离平衡常数:
弱酸 化学式 化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是
| A.等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) |
| B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C.冰醋酸中逐滴加水,则溶液的导电性、pH均先增大后减小 |
| D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-) +2c(CO32-) |
下列离子方程式不正确的是
| A.碳酸氢钙溶液与少量氢氧化钠溶液反应 Ca2++HCO3-+OH-  CaCO3↓+H2O CaCO3↓+H2O |
| B.用Cu和浓硫酸反应制SO2 Cu+4H++SO42-  Cu2++SO2↑+2H2O Cu2++SO2↑+2H2O |
| C.FeSO4溶液中加H2O2溶液 Fe2++2H2O2+4H+=Fe3++4H2O |
| D.向含1molNH4Al(SO4)2溶液中逐滴加入amolNaOH溶液(4<a<5) |
NH4++Al3++aOH- NH3·H2O+(5-a)Al(OH)3↓+(a-4)AlO2-
NH3·H2O+(5-a)Al(OH)3↓+(a-4)AlO2-
某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析正确的是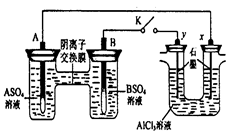
A.溶液中(A2+)浓度减小
B.B的电极反应:B-2eˉ=B2+
C.y 电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
有W、X、Y、Z四种短周期元素,它们的原子序数依次增大,W元素在短周期中原子半径最小,Z元素在同周期元素中离子半径最小,X、Y两元素同周期,Y元素最外层电子数是其内层电子总数的3倍,X元素的核电荷数是Y和Z核电荷数之和的1/3。则下列有关叙述中正确的
| A.X、Y元素分别与W形成的最简单化合物中,Y的化合物沸点低 |
| B.W、X、Y形成的化合物一定是酸 |
| C.Y和Z两元素形成的化合物可用于制坩埚,但不能熔融NaOH固体 |
| D.W、Y、Z形成的某种化合物可作消毒剂 |