黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
请回答下列问题:
(1)化合物B中的含氧官能团为 和 (填名称)。
(2)反应③中涉及到的反应类型有水解反应、 和 。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为 。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式: 。
(5)已知: 。
。
根据已有知识并结合相关信息,写出以 和CH3COOH为原料制备
和CH3COOH为原料制备 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
H2C CH2
CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
A、B、C、D、E是短周期中原子序数依次增大的主族元素,其中元素A的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。常温常压下,E单质是淡黄色固体,常在火山口附近沉积。
(1)CA与水反应放出气体的化学方程式为 。
(2)B 元素的元素符号: ;CA的电子式为 ;
D在元素周期表中的位置为 。
(3)A2E的燃烧热ΔH= -a kJ·mol-1,写出A2E燃烧反应的热化学方程式: 。
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同。回答问题:
① 向丙溶液中缓慢滴加过量的乙溶液过程中发生反应的离子方程式 , 。
② 向甲溶液中缓慢滴加等物质的量的丙溶液后,所得溶液中离子浓度由大到小的顺序为 。
(5)用D单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式: ;由R生成Q的化学方程式: 。
对羟基苯甲酸丁酯是一种很好的药剂,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线: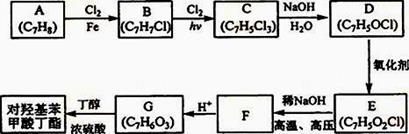
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1 :1。
回答下列问题:
(1)G中官能团的名称为__________________;
(2)B的结构简式为 ;
(3)由C生成D的化学反应方程式为 ;
(4)由E生成F的化学反应方程式为 ;
(5)E的同分异构体中含有苯环且能发生银镜反应的共有______种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2 :2 :1的是 (写结构简式)。
有关FeSO4的转化关系如下图所示(无关物质已略去)。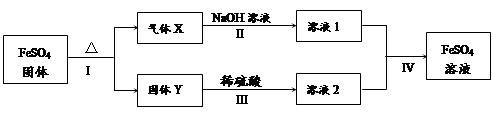
已知:① X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,
产生白色沉淀。
② Y是红棕色的化合物。
(1)气体X的成分是(填化学式) 。
(2)反应I的反应类型属于(填序号) 。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是 。
(4)若经反应I得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol/L NaOH溶液完全吸
收,则反应IV中生成FeSO4的离子方程式是 。
A、B、C、D、E为原子序数递增的短周期元素,在周期表中A是原子半径最小的元素,B、C左右相邻,C、D同主族,D和E的气态氢化物具有相同的电子数,C的单质只有氧化性。
(1)写出实验室制取E2反应的离子方程式_______________________________;
(2)A、C元素按原子个数比为1:1形成化合物的电子式_________________;
(3)某小组设计如图所示的装置(图中夹持和加热装置略去),分别研究DC2和E2的性质.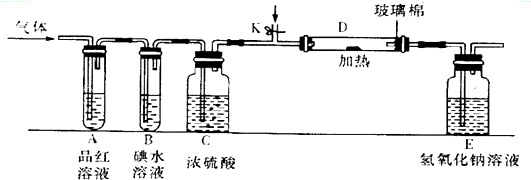
①分别通入DC2和E2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)________;若装置D中装的是铁粉,当通入E2时D中观察到的现象为____________;若装置D中装的是五氧化二钒,当通入DC2时,打开K通入适量C2,化学反应方程式为________________________________。
②若装置B中装有5.0mL l.0×10-3mol/L的碘水,当通入足量E2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为_______________________________。
(4)某同学将足量的DC2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)_________,可以看到白色沉淀生成;
A、氨水 B、稀盐酸 C、稀硝酸 D、氯化钙
(5)若由元素D和C组成一2价酸根Z,Z中D和C的质量比为D:C=4:3,当E2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化铡溶液,有白色沉淀产生.与出E2与Z的溶液完全反应产生浅黄色沉淀的离子方程式______________________________。
(6)A、B、C三种元素组成的碱性物质N,A、B、C、D和一种常见金属元素组成相对分子质量为392的化合物M,1molM中含有6mol结晶水,对化合物M进行如下实验:
a.取含有0.1molM的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和4.48L(标况)无色刺激性气味气体,经一段时间白色沉淀变为灰绿色,最终变为红褪色;
b.另以含有0.1molM的溶液,加入过量BaCl2溶液产生46.6g白色沉淀,加盐酸沉淀不溶解。
①M的化学式为____________________________。
②在25℃下,测定浓度均为amol/L的化合物N和M的混合溶液pH=7,且含金属离子的浓度为bmol/L,则溶液里除H+、金属阳离子外的阳离子浓度为__________mol/L。
物质M是一种日常生活中不可缺少的调味品。已知C在D中燃烧发生苍白色火焰,M与其他物质的转化关系如图甲所示(部分产物已略去);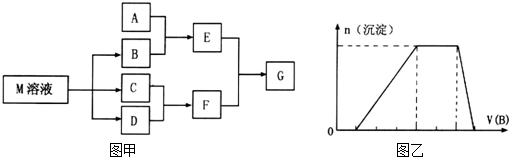
(1)写出用惰性电极电解M溶液的离子方程式___________________________________。
(2)比较B中各元素原子半径大小__________(填元素符号)。
(3)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是______________。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________________________。
(5)若A是一种溶液,只可能含有H+,NH4+,Mg2+,Fe3+,Al3+,CO32-,SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图乙所示.由此可知,该溶液中肯定含有的离子及其浓度之比为___________________________。
(6)若E可用于检验葡萄糖的存在,写出G溶液充分蒸发灼烧后的产物与乙醇反应的化学方程式________。
(7)根据右图,写出25℃时由CO2和H2O转化为葡萄糖溶液的化学方程式______________________。