下列有关说法正确的是
| A.铅蓄电池放电时,正极和负极的电极质量均增大 |
| B.反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H>0 |
| C.加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大 |
| D.C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变 |
在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g) xC(g)符合下图(a)所示的关系(W(C)表示C的体积分数),由此推断关于图(b)的说法正确的是
xC(g)符合下图(a)所示的关系(W(C)表示C的体积分数),由此推断关于图(b)的说法正确的是
A.P3>P4,y轴表示A的转化率B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的平均相对分子质量D.P3>P4,y轴表示混合气体的密度
对于可逆反应A(g)+B(g) C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )
C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )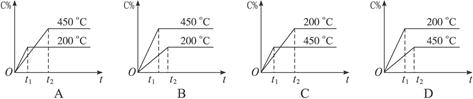
以NA代表阿伏伽德罗常数,则关于热化学方程式C2H2(g)+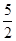 O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
| A.当12NA个电子转移时,该反应放出1300 kJ的能量 |
| B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量 |
| C.当有2NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
| D.当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
在密闭容器中发生如下反应:xA(g)+yB(g) zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是()
zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是()
| A.x+y﹥z | B.平衡向右移动 | C.B的转化率提高 | D.C的体积分数降低 |
航天燃料从液态变为固态,是一项技术突破。铍是高效率的火箭材料,燃烧时放出巨大的能量,每千克的铍完全燃烧放出的热量为62 700 kJ。则铍燃烧的热化学方程式正确的是( )
A.Be+ O2===BeO ΔH=-564.3 kJ·mol-1 O2===BeO ΔH=-564.3 kJ·mol-1 |
B.Be(s)+ O2(g)===BeO(s)ΔH=+564.3 kJ·mol-1 O2(g)===BeO(s)ΔH=+564.3 kJ·mol-1 |
C.Be(s)+ O2(g)===BeO(s)ΔH=-564.3 kJ·mol-1 O2(g)===BeO(s)ΔH=-564.3 kJ·mol-1 |
D.Be(s)+ O2(g)===BeO(g) ΔH=-564.3 kJ O2(g)===BeO(g) ΔH=-564.3 kJ |