研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下放热反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H ="a" kJ/mol (I)
NaNO3(s)+ClNO(g) K1 ∆H ="a" kJ/mol (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H ="b" kJ/mol (II)
2ClNO(g) K2 ∆H ="b" kJ/mol (II)
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),∆H= kJ/mol(用a、b表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),∆H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后
n(Cl2)= mol。其它条件保持不变,反应(II)在恒压条件下进行,平衡常数K2 (填“增大”“减小”或“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1)
(4)由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
有一化学反应2A B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
| 实验 序号 |
浓度(mol/L) |
时间(min) |
|||||||
| 0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
| 1 |
温度 |
800 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800 ℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
| 3 |
800 ℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
(1)在实验1,反应在0至40分钟时间内A的平均速率为mol/(L·min)。
(2)在实验2,A的初始浓度C2=mol/L,可推测实验2中隐含的条件是
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3v1(填>、=、<=,)800℃时,反应平衡常数=,且C3=mol/L,可推测实验3中隐含的条件是。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为mol/L, B的转化率=。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为mol/L, B的转化率=。
(1)有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化;如果把铜浸入C的盐溶液里,有金属C析出。据此,判断它们的活动性由强到弱的顺序是
(2)下列装置可防止铁棒被腐蚀的是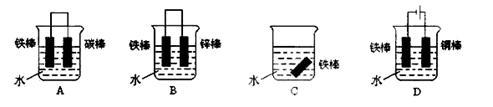
(3)将经过酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示装置中,过一段时间观察,导管中的水柱会上升,说明发生的是(填“吸氧腐蚀”或“析氢腐蚀”)。写出相关的电极反应式:负极,正极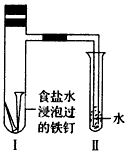
氨气主要用作致冷剂及制取铵盐和氨肥
(1)某研究小组在673K、30MPa条件下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)⇌2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图所示.
下列叙述正确的是.
| A.点a的正反应速率比点b的大 |
| B.点c处反应达到化学平衡状态 |
| C.若t3时由673K升至773K,则n(H2)将增大 |
| D.t2、t3时刻,n(N2)不相等 |
(2)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.①3min内以H2表示的化学反应速率;②该条件下的平衡常数
(3)已知:N2(g)+O2(g)=2NO(g)△H= +180.5kJ/mol
N2(g)+3H2(g)⇌2NH3(g)△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H= -483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
如图为相互串联的甲乙两个电解池,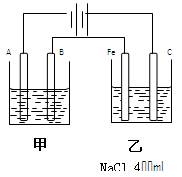
请回答:
(1)甲池若为电解精炼铜的装置,A极是,材料是,电极反应为,B极是,材料是,电极反应为。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为。
(3)若乙槽剩余液体为400mL,求电解后得到碱液的物质的量浓度。
在一定体积的密闭容器中,进行如下化学反应:
C(s)+H2O(g)  CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
| t/(℃) |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.7 |
0.8 |
1.0 |
1.6 |
2.4 |
(1)该反应的化学平衡常数表达式为K=________,该反应为________反应(填“吸热”或“放热”)。
(2)能作为判断反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.c(H20)不变
C.v正(H2)=v逆(H2O) D.c(H2)=c(CO)
(3)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积,平衡________移动(填“正向”、“逆向”或“不”)。H2O(g)的浓度_______,CO(g)的浓度_______(填“变大”、“不变”或“变小”)