如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g.。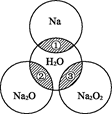
下列说法正确的是
| A.Na2O2晶体中阴阳离子数目之比为1∶1 |
| B.反应③最多能产生0.05 mol O2 |
| C.反应①的离子方程式为Na+2H2O==Na++2OH-+H2↑ |
| D.①、②、③充分反应后所得溶液的质量分数从大到小的顺序为①>②>③ |
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为()。
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
下图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是()。
| X |
|||
| W |
Y |
R |
|
| Z |
A.W、R元素单质分子内的化学键都是非极性键
B.X、Z元素都能够形成双原子分子
C.键能W—H>Y—H,键的极性Y—H>W—H
D.键长X—H<W—H,键能X—H<W—H
下列各说法中正确的是()。
| A.分子中键能越大,键长越长,则分子越稳定 |
| B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键 |
| C.水分子可表示为H—O—H,分子中键角为180° |
| D.H—O键键能为463 kJ·mol-1,即18克H2O分解成H2和O2时,消耗能量为2×463 kJ |
下列分子中键能最大的是()。
| A.HF | B.HCl | C.HBr | D.HI |
从键能的角度来看,下列物质中与H2化合时,最难的是()。
| A.氟气 | B.氮气 | C.氯气 | D.氧气 |