(16分)氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)NaH是一种生氢剂,NaH与H2O反应放出H2.NaH含有的化学键为________(填“离子键”或“共价键”),NaH与H2O反应的化学方程式为________________.
(2)写出实验室用锌与稀硫酸反应制取H2的离子方程式:_________.图中三根曲线表示锌、铝、铁分别与稀硫酸反应时金属质量与H2体积的关系,其中能表示铝的是________(填“a”“b”或“c”).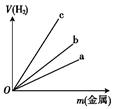
(3)金属-有机框架物(MOFs)储氢材料是由金属氧化物团簇通过有机高分子链组装形成的晶态材料.MOFs储氢材料比表面积大,空隙率高,储氢容量大,其储氢和放氢的原理可表示为MOFs(s)+nH2(g)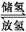 (H2)nMOFs(s),ΔH<0,则储氢时的适宜条件为________(填字母).
(H2)nMOFs(s),ΔH<0,则储氢时的适宜条件为________(填字母).
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(4)某硝酸厂处理尾气中的NO的方法是用H2将NO还原为N2.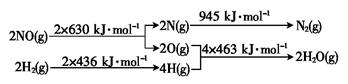
已知:H2还原NO生成氮气和水蒸气的热化学方程式是_________________________.
(5)一定条件下,用H2将二氧化碳转化为甲烷的反应如下:
CO2(g) + 4H2(g) CH4(g) + 2H2O(g)
CH4(g) + 2H2O(g)
向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10 min后达到平衡时各物质的浓度分别为: CO2为0.2 mol·L-1, H2为0.8 mol·L-1, CH4为0.8 mol·L-1, H2O为1.6 mol·L-1.
①0~10 min内v(H2)=_______________.
②300℃时上述反应的平衡常数K=___________,若200℃时该反应的平衡常数K=64.8,则该反应的ΔH__________(填“>”或“<”)0.
(1)Cu(NO3)2的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈性,原因是(用离子方程式表示):______,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的。
将金属钠投入盛有CuSO4溶液的小烧杯中,可观察到有气泡和沉淀生成,反应的化学方程式有;,有时有黑色物质生成,该物质是。
.Na2CO3固体中混有少量NaHCO3,除去杂质的方法是,反应方程式为;Mg中混有少量Al,除去杂质的方法是,反应的离子方程式为;除去CO2气体中少量HCl,所用试剂是,反应的离子方程式为。
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应的热化学方程式。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g)△H < 0,其平衡常数K与温度T的关系如下表:
2NH3(g)△H < 0,其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g)△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
2NO2(g)△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
I、属于非电解质的是(填序号)Ⅱ、⑴NaHCO3是一种(填“强”或“弱”)电解质;
⑵写出HCO3―水解的离子方程式:;
⑶常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、H2CO3、CO32―、OH―五种微粒的浓度由大到小的顺序为:。
⑷常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
Ⅲ 、Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
⑴溶液中由水电离出c(OH―)=______________;
⑵与某浓度盐酸溶液按体积比(碱与酸之比)1: 9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。