下列有关溶液中粒子浓度关系的比较中不正确的是
A.饱和氯水中滴加0.1 mol·L-1的NaOH溶液,溶液pH=7时:c(Na+)=2c(ClO-)+c(HClO)
B.已知HF的酸性比CH3 COOH的强,pH相等的NaF与CH3 COOK溶液中:c(Na+)-c(F-)=c(K+) -c(CH3COO-)
C.0.lmol/L pH为1的NaHB溶液中:c(Na+)>c(B2﹣)>c(H+)>c(OH﹣)
D.常温下,向20.00 mL 0.100 mol·L-1 NaA溶液中逐滴加入0.100 mol·L-1盐酸溶液的pH=7时:c(HA)=c(Cl-)>c(OH-)=c(H+)
下列化合物分子中的所有碳原子不可能处于同一平面的是:
| A.甲苯 | B.硝基苯 | C.2—甲基丙烷 | D.2—甲基丙烯 |
下列表述正确的是
A.醛基的结构简式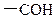 |
B.聚丙烯的结构简式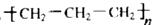 |
C.四氯化碳分子的电子式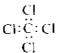 |
D.丙烷分子的球棍模型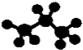 |
根据下列反应步骤,由2-丙醇转化为1,2—丙二醇(HOCH2—CH2OH—CH3)的正确的反应类型的顺序是
| A.消去―取代―加成 | B.取代―消去―加成 |
| C.消去―加成―水解 | D.水解―取代―取代 |
等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置片刻后取出,铜片质量与加热前相同的是
| A.石灰水 | B.无水乙醇 | C.硝酸 | D.盐酸 |
下面四种变化中,有一种变化与其他三种变化类型不同的是
A.CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O CH3COOCH2CH3 + H2O |
B.CH3CH2OH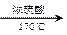 CH2=CH2↑+H2O CH2=CH2↑+H2O |
C.CH4 +Cl2 CH3Cl+HCl CH3Cl+HCl |
D.CH3CH2OH + HBr CH3CH2Br + H2O CH3CH2Br + H2O |