如图为示意图,下列说法正确的是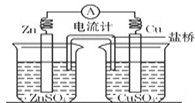
| A.电子从锌片流向铜片 |
| B.若以含氯化钾的琼脂作盐桥,则氯离子定向移动到右边的烧杯 |
| C.铜片逐渐溶解,发生氧化反应 |
| D.该装置是将电能转变为化学能的装置 |
常温下0.1mol/L碳酸溶液中,下列离子关系式正确的是
| A.c(H+)="2" c(CO32-)+c(OH-) |
| B.0.1= c(HCO3-)+2c(CO32-) |
| C.c(OH-)= c(H+) - c(HCO3-)-2 c(CO32-) |
| D.c(H+)>c(CO32-) > c(HCO3-) |
某密闭容器中充入等物质的量A和B,一定温度下发生反应: A(g)+xB(g)  2C (g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列说法正确的是
2C (g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列说法正确的是
| A.30 min时降低温度,40 min时升高温度 |
| B.反应方程式中x=1,正反应为放热反应 |
| C.该反应在第8 min时达到化学平衡状态 |
| D.30~40 min间该反应使用了催化剂 |
若室温时pH=a的氨水与pH=b的盐酸等体积混和,恰好完全反应,则该氨水中的一水合氨电离的百分比可表示为
| A.10(a+b-12)% | B.10(a+b-14)% | C.10(12-a-b)% | D.10(14-a-b)% |
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度(mol·L-1) |
0.1 |
0.2 |
0 |
| 平衡浓度(mol·L-1) |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z
2Z
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.因该反应的热效应未知,升高温度,平衡常数可能增大,也可能减小
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO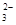 )、c(HCO3-)都减少,其方法是
)、c(HCO3-)都减少,其方法是
| A.通入二氧化碳气体 | B.加入饱和石灰水溶液 |
| C.通入氯化氢气体 | D.加入氢氧化钠固体 |