下列有关物质性质的应用正确的是
| A.氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水 |
| B.碳酸钠溶液与稀盐酸、铁与氯气发生反应,由于反应物的用量不同而得到不同产物 |
| C.因为浓硝酸具有强氧化性,所以不能用铁制或铝制容器盛放 |
| D.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
下列溶液中各微粒的浓度关系不正确的是
A.0.1mol/LHCOOH溶液中: |
B. 的溶液中: 的溶液中: |
C.0.1 mol/L NaHCO3溶液中: |
| D.将0.2 mol/LHCN溶液和0.1 mol/L的NaOH溶液等体积混合后,溶液显碱性 |

镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。己知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行: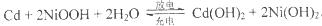
有关该电池的说法正确的是
| A.充电过程是化学能转化为电能的过程 |
B.充电对阳极反应: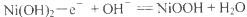 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
下列叙述正确的是
A.0.1 mol/LNaClO溶液中: |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水电离出的c(H+)相等 |
| D.在少量Na2S的饱和溶液中加入一定量的AgCl固体,溶液中C(S2-)下降 |
已知 表示阿伏加德罗常数的值,下列叙述不正确的是
表示阿伏加德罗常数的值,下列叙述不正确的是
| A.氯化铁溶液加热蒸干最终得不到氯化铁固体 |
| B.镀锡的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 |
C.电解精炼铜时,每转移2 mol电子阳极上溶解的铜原子数为 |
D.在lL0.lmol 碳酸钠溶液中,阴离子总数大于0.1 碳酸钠溶液中,阴离子总数大于0.1 |
在下列给定条件的溶液中,一定能大量共存的离子组是
A.由水电离的c(H+)=lxl0 mol/L的溶液中: mol/L的溶液中: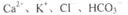 |
B.能使pH试纸呈红色的溶液; |
C. =0.1mol/L的溶液: =0.1mol/L的溶液: |
D.FeCl2溶液: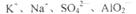 |