下列根据实验操作及现象所得出的结论中,正确的是
| 选项 |
实验目的 |
实验方案 |
| A |
检验亚硫酸钠试样是否变质 |
取适量试样溶于水,滴加硝酸钡溶液产生白色沉淀,再滴加稀盐酸,沉淀不溶解,说明试样已变质 |
| B |
证明Na2CO3溶液中存在水解平衡 |
在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色褪去。 |
| C |
验证Ksp(AgCl)>Ksp(AgI) |
向5 mL 0.1 mol/L AgNO3溶液中滴加3滴0.1 mol/LNaCl溶液,产生白色沉淀;再向其中滴加3滴0.1mol/L的KI溶液,有黄色沉淀产生 |
| D |
溴和苯发生加成反应 |
将苯滴入溴水中,振荡,静置,溴水层褪色 |
2009年10月30日世界卫生组织称世界80%的人将会感染甲型H1N1流感,并推荐患者使用达菲等药物。达菲是由我国特有中药材八角的提取物——莽草酸(shikimicacid)为原料合成的。鞣酸存在于苹果、生石榴等植物中,已知莽草酸、鞣酸、达菲的结构式如下: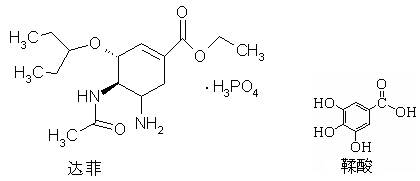
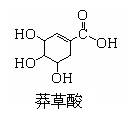
下列判断正确的是
| A.达菲与莽草酸它们互为同系物,鞣酸与莽草酸互为同分异构体 |
| B.这三种有机物在一定条件下都能与氢气、溴发生加成反应 |
| C.达菲的分子式C16H28N2O4•H3P O4 |
| D.碳酸氢钠溶液可以检验这三种有机物 |
下列物质的分类正确的是
| A |
B |
C |
D |
| 淀粉—混合物 |
石炭酸—有机物 |
液氯—非电解质 |
绿矾—分子晶体 |
| 明矾—纯净物 |
纯碱—盐 |
碳酸钙—强电解质 |
碳化钙—离子晶体 |
| 盐酸—化合物 |
双氧水—氧化物 |
醋酸—弱电解质 |
氮化硅—原子晶体 |
| 聚苯乙烯---烃 |
甘油—醇类 |
氨水---电解质 |
铜------金属晶体 |
| 过氧化钠-共价化合物 |
钾盐---离子化合物 |
含氧酸—共价化合物 |
铵盐----离子化合物 |
乙酰水杨酸(俗称阿司匹林)是一种常见的解热、消炎、镇痛的药物。以苯为主要原料,可通过下图所示途径来合成:
已知:R-X+H2O→R-OH+HX(R为烃基,X为卤素原子)
请回答下列问题:
(1)写出有机物的结构简式:A ,B 。
(2)下列关于阿司匹林的叙述正确的是(填序号)。
| A.可与Na2CO3溶液作用生成CO2 | B.一定条件下,可发生加成、取代、酯化、氧化反应等 |
| C.属于芳香烃类化合物 | D.可使滴有酚酞的NaOH溶液褪色 |
E. 使溴的四氯化碳溶液因发生加成反应而褪色
(3)变化过程中反应⑦的反应类型是。
(4)写出反应①、⑥的化学方程式(有机物写结构简式、注明反应条件):① ;
⑥ 。
(5)冬青油具有多种同分异构体,请写出一种符合下列条件的同分异构体:。(分子结构中含
有苯环、属于醇类(-OH不能直接连接在苯环上)且1mol该同分异构体与足量金属钠作用能够生成1molH2)。
向100 mL 0.25 mol·L-1的AlCl3溶液中加入下列物质恰好完全反应,生成只含NaCl和NaAlO2的澄清溶液,符合要求的是
| A.Na,4.6 g | B.Na2O2,7.8 g | C.NaH, 2.4 g | D.Na2O,12.4 g |
下列说法正确的是
A.在周期表中,族序数都等于该元素的最外层电子数. |
B.非金属性最强的元素,其氢化物溶于水的酸性最强 |
C.碱金属随原子序数增大,熔点降低;卤族元素的单质,随原子序数增大,熔点依次升高. |
| D.同一周期的主族元素,从左至右,原子半径减小,它们所形成的简单离子半径从左至右依次增大 |