(15分)合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2 (g) + 3H2 (g) 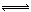 2NH3 (g) △H = -92.4 kJ·mol-1 ,一种工业合成氨的简易流程图如下:
2NH3 (g) △H = -92.4 kJ·mol-1 ,一种工业合成氨的简易流程图如下:

(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(2)步骤Ⅱ中制氢气原理如下:
①CH4 (g) + H2O (g) 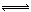 CO (g) + 3H2 (g) △H = +206.4 kJ·mol-1
CO (g) + 3H2 (g) △H = +206.4 kJ·mol-1
②CO (g) + H2O (g) 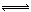 CO2 (g) + H2 (g) △H = -41.2 kJ·mol-1
CO2 (g) + H2 (g) △H = -41.2 kJ·mol-1
写出氢气和二氧化碳气体反应生成甲烷和水蒸气的热化学方程式 。
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为 。
(3)图1表示500℃、60.0 M Pa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数___________。

(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) 。
简述本流程中提高合成氨原料总转化率的方法(任写一种) 。
(5)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
来自石油的有机化工原料A,其产量已作为衡量一个国家石油化工发展水平的标志,A可以发生如下转化: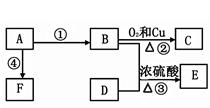
已知:E是具有果香味的有机物,其分子式为C4H8O2,F是一种高分子化合物。
(1)A的分子式是 ,C的名称是 。
(2)D分子中的官能团名称是 ,证明该官能团具有酸性的方法是 。
(3)反应③的化学方程式是;反应④的类型是反应。
短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为。
(3)X、Y、Z三种元素组成的化合物中存在的化学键类型为。
(4)Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为。
下表是元素周期表的一部分:
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是 ,非金属性最强的元素是 。
(2)化学性质最不活泼的元素是 ,其原子结构示意图为 。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是 。
(5)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是。
(7分)现有下列八种物质: HCl、NH4Cl、N2、Na2O2、CaCl2、Cl2、NaF、CO2
回答下列问题:
(1)只含有离子键的物质是 (填化学式,下同)。
(2)既含有离子键,又含有共价键的物质是 。
(3)属于共价化合物的是 ,其中所有原子都满足8电子结构的是 。
(9分)某有机化合物A含碳76.6%、含氢6.4%,A的相对分子质量约是甲烷的5.9倍。在常温下,该有机物的稀溶液可与浓溴水反应生成白色沉淀,1molA恰好跟3molBr2反应。
(1)求A的分子式 。
(2)写出A的稀溶液中滴加浓溴水的化学方程式__________________。
(3)写出A与碳酸钠、碳酸氢钠溶液可能发生的反应的离子方程式。