(15分)高纯MnCO3是制备电讯器材、颜料、催化剂及高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:

(1)制备MnSO4溶液:在三颈烧瓶中加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h,停止通入SO2,继续反应片刻,过滤。
①依次写出烧瓶中和烧杯中反应的化学方程式为 、 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定,不改变固液投料的条件下,可采取的合理措施有 。
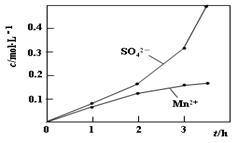
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图。导致溶液中Mn2+、SO42-的浓度变化产生明显差异的主要原因是 。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤如下[实验中可选用的试剂限制为:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。

步骤①中为防止生成Mn(OH)2沉淀,注意 ;选择步骤②中所用试剂的理由是 ;步骤③是 。
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。
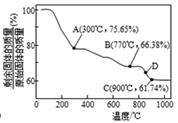
则加热至300℃时,发生反应的化学方程式为 ;图中点D对应固体的成分为 (填化学式)。
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是 ;若反应过程中转移了0.3mol电子,则氧化产物的质量是g。
;若反应过程中转移了0.3mol电子,则氧化产物的质量是g。
(2)镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的稀硫酸),电池总反应为:Mg+H2O2+H2SO4= MgSO4 +2H2O。该电池工作时,正极发生的电极反应式为:。此时,正极周围海水的pH:(填:增大、减小或不变)
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O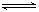
 Al(OH)4-+ H+②NH3+H2O
Al(OH)4-+ H+②NH3+H2O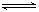 NH4+ + OH-
NH4+ + OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式。
(B)已知N2H4是二元弱碱,试写出其第二步电离方程式。
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了系列实验。
(1)用下图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当
时(填实验现象),说明“铁与水蒸气”能够进行反应。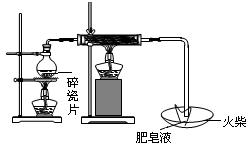
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称取一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算出铁粉的转化率。
①收集并测量气体体积应选右图中的________装置(填A或B)。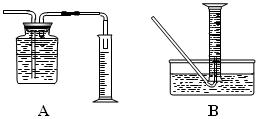
②称取0.24g铁粉与适量石棉绒混合,然后加热至无气体放出。若室温下氢气密度约为0.088g/L,最好选用 规格的量筒(选填字母序号)
A.100mLB.200mL C.500mLD.1000mL
③收集的气体体积为VL,铁粉的转化率为 。
(3)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解、过滤。向滤液中滴加KSCN溶液,观察溶液的颜色。在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满)。
| 现象 |
结论与解释 |
|
| 可能① |
||
| 可能② |
(1)研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,
其中合理的是(填序号)
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解 |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象。
实验装置实验现象
下图是一个制取氯气并以氯气为原料进行某个特定反应研究的装置。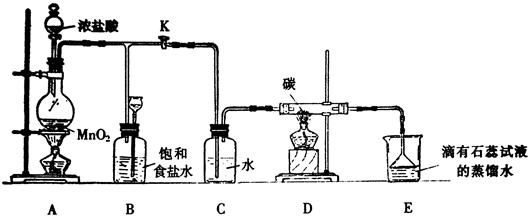
(1)实验开始时,先点燃A处的酒精灯,打开K,使Cl2充满整个装置,再点燃D处酒精灯,然后连接上E装置;E处石蕊试液先变红然后渐变为无色,同时漏斗中的液面略有上升,则产生颜色变化的原因是
a.反应中产生CO2的缘故 b.反应中产生HCl的缘故
c.反应中产生HCl并有Cl2溶于水 d.反应中同时有CO2、HCl产生的缘故
D处反应的化学方程式为。
(2)装置C的作用是。
(3)若将E处中的液体改为澄清石灰水,反应过程中的现象为。
a.有白色沉淀产生 b.先生成白色沉淀而后沉淀消失
c.无明显现象 d.开始无沉淀,然后产生白色沉淀
(4)当反应结束后关闭K,移去A处酒精灯,由于余热作用,A处仍有Cl2产生,此时B中现象为,B的作用是 。
。
(5)E装置无法确认D处反应中有CO2产生,为了证明CO2的存在,要对E装置进行改变,下列装置符合要求的是。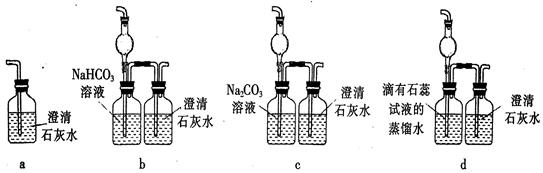
(6)本实验的目的是。
某课外活动小组设计了以下实验方案探究Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下: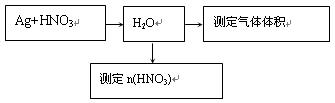
(1)测定NO的体积: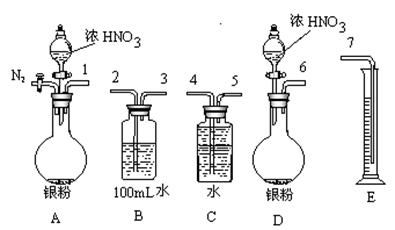
①从上图所示的装置中,你认为应选用装置进行Ag与浓硝酸反应实验。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
3→(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(2)测定硝酸的物质的量:反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,第一次滴定前后的滴定管中液面的位置如右图所示。请将读数填到表格的相应位置: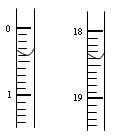
| 滴定前读读数/mL |
滴定后读数/mL |
|
| 第一次 |
||
| 第二次 |
0.10 |
18.00 |
| 第三次 |
0.20 |
18.30 |
依据表格的数据计算出在B容器中生成硝酸的物质的量为mol。
(3)气体成份分析:
若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程中
(填“有”或“没有”)NO产生,作此判断的依据是。