在标准状况下,将aLNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为Cmol/L。下列叙述中正确的是①ω=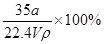 ②C=
②C=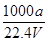
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为: c(Cl-) >c(NH4+) >c(H+) >c(OH-)
| A.①④ | B.②③ | C.①③ | D.②④ |
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是()
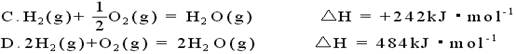
已知可逆反应2SO2+O2 2SO3是放热反应,下列说法正确的是
2SO3是放热反应,下列说法正确的是
| A.2molSO2 与1molO2 能完全反应生成2molSO3 ,升高温度可以加快此反应的化学反应速率 |
| B.2molSO2 与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率 |
| C.2molSO2 与1molO2 能完全反应生成2molSO3 ,升高温度减慢此反应的化学反应速率 |
| D.2molSO2 与1molO2 不能完全反应生成2molSO3 ,升高温度减慢此反应的化学反应速率 |
同一主族的X 、 Y 、 Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H3YO4<H3ZO4 ,下列推断正确的是
| A.原子序数: X<Y<Z |
| B.气态氢化物稳定性: XH3>YH3>ZH3 |
| C.元素的非金属强弱: X>Y>Z |
| D.电子层数: X>Y>Z |
X元素的气态氢化物的化学式为H2X,则X的最高正价氧化物的对应的水化物的化学式为( )
| A.H2XO3 | B.X(OH)2 | C.H3XO4 | D.H2XO4 |
下列化合物中,阳离子半径与阴离子半径比值最小的是( )
| A.NaF | B.NaCl | C.MgI2 | D.KBr |